题目内容
【题目】

(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响? (填“偏大”“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面: 。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水: 。
(4)硅单质是一种重要的非金属单质,其用途是 (举一例)
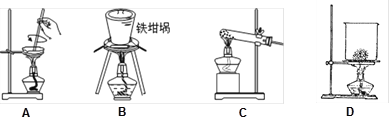
(5)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
(6)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
【答案】(1)11.9 mol·L-1。
(2)BD
(3)①16.8mL ;②a.偏小;b.偏小
(4)半导体、电子芯片、光电池
(5)B
(6)2.4 mol/L≥c≥1.2 mol/L
【解析】试题分析:(1)质量分数36.5%、密度1.19g/mL 浓盐酸的物质的量浓度=![]() =11.9mol/L。故答案为:11.9;
=11.9mol/L。故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关。故答案为:BD;
(3)①令需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:
V×10-3L×11.9mol/L="0.5" L×0.400mol/L,解得:V=16.8。
故答案为:16.8;
②在配制过程中,Ⅰ.a.用量筒量取浓盐酸时俯视观察凹液面,造成量取浓盐酸的体积偏小,导致最终所配溶液浓度偏低;b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,所配溶液浓度偏小。
故答案为:偏小;偏小;
(4)硅单质是一种重要的非金属单质,其用途主要有:半导体材料、电子芯片、光电池(举一例)。
故答案为:半导体、电子芯片、光电池;
(5)由于高温条件下SiO2和NaOH焙烧制备硅酸钠,所以完成该实验时可采用的装置为B(填代号)。
故答案为:B;
(6)某H2中含有2.40molCO2,该混合气体通入2.00LNaOH溶液中,CO2被完全吸收。设NaOH的物质的量为xmol,如果NaOH完全反应生成Na2CO3,则x=2n(CO2)=2.40mol×2=4.80mol,c(NaOH)=4.80mol/2.00L=2.4mol/L;
如果NaOH完全反应生成NaHCO3,则x=n(CO2)=2.40mol,(NaOH)=2.40mol/2.00L=1.2mol/L;
该NaOH溶液的浓度为:2.4mol/L≥c≥1.2mol/L。

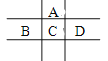
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足下图所示转化关系的是( )

甲 | 乙 | 丙 | 戊 | |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |