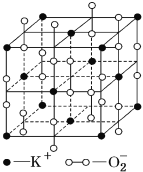
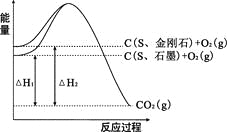
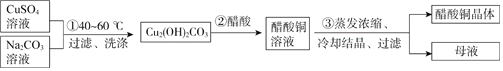
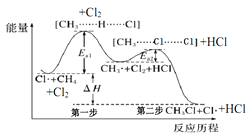
题目内容
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤常温下,分别取滤液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.加入过量氨水:Fe3+、![]() 、
、![]() 、OH-
、OH-
B.加入过量NaOH溶液:Na+、[Al(OH)4]-、![]() 、OH-
、OH-
C.加入过量H2O2溶液:Fe2+、H+、![]() 、Cu2+
、Cu2+
D.加入过量 NaHCO3溶液:Na+、Al3+、![]() 、
、![]()
【答案】B
【解析】
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),加入过量硫酸溶解后过滤,SiO2不反应,则滤液中含有的离子为:Cu2+、Fe3+、Fe2+、Al3+、SO42-、H+;
A.加入过量氨水后,Fe3+与氨水反应生成氢氧化铁沉淀,反应后溶液中不会大量存在Fe3+,故A错误;
B.加入过量NaOH溶液后,Cu2+、Fe3+、Fe2+反应生成难溶物,Al3+反应生成[Al(OH)4]-,所以反应后溶液中存在离子为Na+、[Al(OH)4]-、SO42-、OH-,故B正确;
C.H2O2具有强氧化性,Fe2+有还原性,H2O2能够氧化Fe2+变为Fe3+,反应后溶液中不会大量存在Fe2+,故C错误;
D.加入过量 NaHCO3溶液,Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以反应后溶液中不会大量存在Al3+,故D错误;
答案为B。

【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D
【题目】直接排放含SO2的烟气会形成酸雨危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应原理为__。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式为__。
(3)吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如表:
)变化关系如表:
n( | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性__(填“酸”或“碱”),用化学平衡原理解释__。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(填字母编号)__。
a.c(Na+)=2c(![]() )+c(
)+c(![]() )
)
b.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
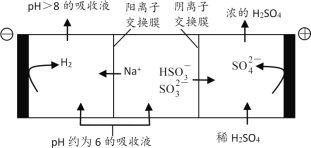
①![]() 在阳极放电的电极反应式是__。
在阳极放电的电极反应式是__。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理__。