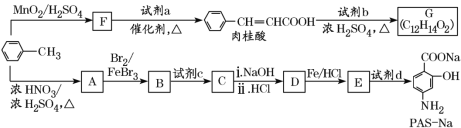
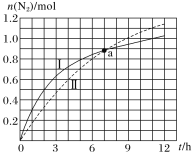
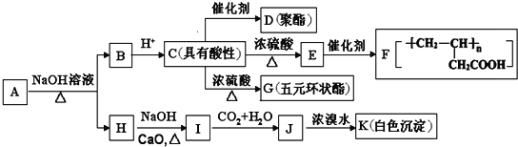
题目内容
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂,不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示:
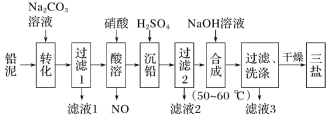
已知:Ksp(PbSO4)=1.82×10-8;Ksp(PbCO3)=1.46×10-13。回答下列问题:
(1)加Na2CO3溶液转化的目的是__。
(2)酸溶时,不直接使用H2SO4溶液的原因可能是__;铅与硝酸在酸溶过程中发生反应的离子方程式为__。
(3)流程中可循环利用的物质是__;洗涤操作时,检验沉淀是否洗涤干净需要的试剂是__。
(4)当沉淀转化达平衡时,滤液l中c(![]() )与c(
)与c(![]() )的比值为__。
)的比值为__。
(5)50~60℃时合成三盐的化学方程式为__;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__。
【答案】将PbSO4转化为PbCO3,提高铅的利用率 生成的PbSO4为难溶物,阻碍反应持续进行 ![]() HNO3 盐酸、BaCl2溶液 1.25×105 4PbSO4+6NaOH
HNO3 盐酸、BaCl2溶液 1.25×105 4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O 51.75%
3PbOPbSO4H2O+3Na2SO4+2H2O 51.75%
【解析】
以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐:向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
(1)向铅泥中加Na2CO3溶液,由题可知PbCO3的溶解度小于PbSO4的溶解度,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),则可将PbSO4转化成PbCO3,提高铅的利用率,故答案为:将PbSO4转化为PbCO3,提高铅的利用率;
(2)因硫酸铅难溶于水,不能加入硫酸酸溶,否则生成的PbSO4为难溶物,阻碍反应持续进行,铅与硝酸反应生成Pb(NO3)2和NO、H2O的离子方程式为:![]() ,故答案为:生成的PbSO4为难溶物,阻碍反应持续进行;
,故答案为:生成的PbSO4为难溶物,阻碍反应持续进行;![]() ;
;
(3)Pb、PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,HNO3可循环利用,检验沉淀是否洗涤干净的方法是取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净,故答案为:HNO3;盐酸、BaCl2溶液;
(4)当沉淀转化达平衡时,滤液l中![]() 与
与![]() 的比值为二者对于铅盐溶度积之比,为
的比值为二者对于铅盐溶度积之比,为![]() ,故答案为:1.25×105;
,故答案为:1.25×105;
(5)步骤⑥合成三盐的化学方程式为:4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O,若得到纯净干燥的三盐99.0t,则其中铅元素的质量为:
3PbOPbSO4H2O+3Na2SO4+2H2O,若得到纯净干燥的三盐99.0t,则其中铅元素的质量为:![]() ,设铅泥中铅元素的质量分数为w,则200.0t铅泥中铅元素为200×w,铅泥中的铅元素有80%转化为三盐,有200×w×80%=82.8,解得x=51.75%,故答案为:4PbSO4+6NaOH
,设铅泥中铅元素的质量分数为w,则200.0t铅泥中铅元素为200×w,铅泥中的铅元素有80%转化为三盐,有200×w×80%=82.8,解得x=51.75%,故答案为:4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O;51.75%。
3PbOPbSO4H2O+3Na2SO4+2H2O;51.75%。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案