题目内容
【题目】磷石膏是湿法生产磷酸的固体废弃物,用磷石膏生产硫酸或硫,既可减少对环境的污染又可使资源循环利用。回答下列问题:
(1)用焦炭、硫磺等均可还原磷石膏。已知下列反应:
I .CaSO4(s)+2C(s)=CaS(s) +2CO2(g) H1=+226kJ·mol—1
II.3CaSO4 (s)+CaS(s)=4CaO(s) +4SO2(g) H2=akJ·mol—1
III. 3CaS(s)+CaSO4 (s) =4CaO(s) +4S(s) H3=bkJ·mol—1
①反应(I)能在______(填“低温”“高温”或“任何温度”)下自发进行。
②用硫磺还原CaSO,反应为2CaSO4(s)+S(s)=2CaO(s)+3SO2 (g),其△H=___ kJ·mol—1(用含a、b的代数式表示)。
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3![]() CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=________[已知:Ksp (CaCO3)=2. 5×10—9,Ksp(CaSO4)=3. 2×10—7],为了提高CaSO4的平衡转化率,可采取的措施是_______________________________。(写一条)。
CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=________[已知:Ksp (CaCO3)=2. 5×10—9,Ksp(CaSO4)=3. 2×10—7],为了提高CaSO4的平衡转化率,可采取的措施是_______________________________。(写一条)。
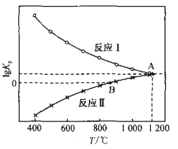
(3)一氧化碳还原CaSO4可发生下列反应,其lgKp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。
I .SO2(g)+3CO(g) ![]() 2CO2(g)+COS(g)
2CO2(g)+COS(g)
II .CaSO4(s)+CO(g) ![]() CaO(s)+CO2 (g)+SO2(g)
CaO(s)+CO2 (g)+SO2(g)
①△H>0的反应是_______(填“I”或“II”)。
②在交点A处,气体分压间满足的关系是:p (COS) =_____
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是___________(填字母)。
a. 2v(CO) 正=3v(CO2)正
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d. ![]() 的值不再随时间而变化
的值不再随时间而变化
④若在1.0 L的恒容密闭容器中加入1mol CaSO4,并充入1molCO,只发生反应II。在B点时气体总压强为1 MPa,则此时CaSO4转化率为________(已知![]() 1.41).
1.41).
【答案】高温 ![]() 128 增大CO32-的浓度 Ⅱ
128 增大CO32-的浓度 Ⅱ ![]() cd 70.9%
cd 70.9%
【解析】
(1)①根据G=H-TS分析;
②用盖斯定律计算反应2CaSO4(s)+S(s)=2CaO(s)+3SO2 (g)的△H。
(2)用离子方程式计算反应的平衡常数K;为了提高CaSO4的平衡转化率,使平衡向右移动,根据影响平衡的因素分析。
(3)①根据温度对平衡常数的影响分析。
②在交点A处,反应Ⅰ和反应Ⅱ的Kp相等。
③平衡时,正逆反应速率相等,各组分的物质的量、浓度等不随时间而变化,据此分析。
④列三段式计算CaSO4的转化率。
(1)①G=H-TS<0的反应能自发进行。根据反应(I)的化学方程式可知,该反应的S>0,已知该反应的H1=+226kJ·mol—1>0,要使G<0,需要比较高的温度,故答案为:高温。
②根据盖斯定律,把(反应Ⅱ×3-反应Ⅲ)÷4,即得反应2CaSO4(s)+S(s)=2CaO(s)+3SO2 (g),其△H= ![]() kJ·mol—1。
kJ·mol—1。
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3![]() CaCO3(s)+(NH4)2SO4,改写成离子方程式为:CaSO4(s)+ CO32-
CaCO3(s)+(NH4)2SO4,改写成离子方程式为:CaSO4(s)+ CO32-![]() CaCO3(s)+ SO42-,该反应的平衡常数K=
CaCO3(s)+ SO42-,该反应的平衡常数K=![]() =
=![]() =
=![]() =
=![]() =128;为了提高CaSO4的平衡转化率,需使平衡正向移动,可增大CO32-浓度或降低SO42-浓度。
=128;为了提高CaSO4的平衡转化率,需使平衡正向移动,可增大CO32-浓度或降低SO42-浓度。
(3)①由图像可知,温度升高,反应I的平衡常数降低,说明I正反应是放热的,反应II的平衡常数升高,说明反应II的正反应是吸热的,故△H>0的反应是II。
②在交点A处,反应Ⅰ和反应Ⅱ的Kp相等,即![]() ,所以p (COS) =
,所以p (COS) =![]() 。
。
③a. 都是正反应速率,无法判断正逆反应速率是否相等,错误;
b.反应物和生成物都是气体,混合气总质量是不变的,容器容积固定,所以气体密度一直不变,故气体的密度不再随时间变化不能说明反应达到了平衡状态,错误;
c.该反应前后气体系数和不等,所以压强一直在变小,平衡时才不再随时间变化,正确;
d. 随着反应的进行,生成物浓度在增大,反应物浓度在降低,所以![]() 的值一直在增大,当平衡时,此比值不再随时间而变化,故
的值一直在增大,当平衡时,此比值不再随时间而变化,故![]() 不再变化时反应达到平衡状态,正确;
不再变化时反应达到平衡状态,正确;
故选cd。
④若在1.0 L的恒容密闭容器中加入1mol CaSO4,并充入1molCO,发生反应II。在B点时气体总压强为1 MPa,lgKp=0,即![]() =1。设转化的CaSO4的物质的量为x,列三段式:
=1。设转化的CaSO4的物质的量为x,列三段式:
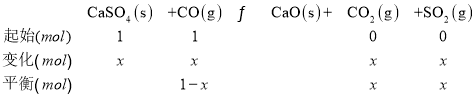
p(CO)=![]() ,p(CO2)=p(SO2)=
,p(CO2)=p(SO2)=![]() ,Kp=
,Kp=![]() =
=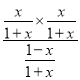 =1,解得x=0.709,则此时CaSO4转化率为
=1,解得x=0.709,则此时CaSO4转化率为![]() ×100%=70.9%。
×100%=70.9%。

 名校课堂系列答案
名校课堂系列答案