题目内容
【题目】化学与生活密切相关。
I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为__。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为__,碳原子的轨道杂化类型为__,所含σ键与π键的数目之比为__。
(3)已知Cr3+等过渡元素水合离子的颜色如表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为__。
II.ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有__(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为__。
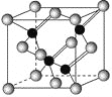
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。
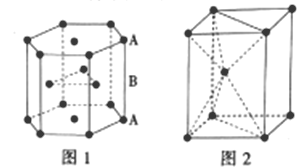
(5)锌的堆积方式为__,配位数为__。
(6)若锌原子的半径为apm,阿伏加德罗常数的值为NA,则锌晶体的密度为___g/cm3(用含a的代数式表示)。
【答案】![]() O>C>H sp3和sp2 7:1 3d轨道上没有未成对电子(3d轨道上电子为全空或全满) AC
O>C>H sp3和sp2 7:1 3d轨道上没有未成对电子(3d轨道上电子为全空或全满) AC 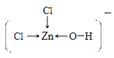 或
或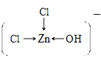 六方最密堆积 12
六方最密堆积 12 ![]() 或
或![]()
【解析】
(1)基态Cr原子的的原子序数是24,价电子排布式为3d54s1;
(2)电负性是原子对键合电子的吸引力的大小;对于碳原子,碳碳单键是sp3杂化,碳碳双键和碳氧双键是sp2杂化,三键是sp杂化;单键都是σ键,双键中一个是σ键,一个是π键;
(3)根据电子排布式可推测离子有无颜色;
(4)Fe[Zn(OH)Cl2]2在溶液中以阴阳离子的形式存在,没有离子键,Fe[Zn(OH)Cl2]2是配合物,存在共价键、配位键,水分子间还有范德华力和氢键;[Zn(OH)Cl2]-中Zn提供空轨道,氯原子和氧原子提供孤对电子形成配位键。
(5)从锌的堆积方式图可以看出,锌的堆积方式为六方最密堆积,最密堆积的配位数为12;
(6)若锌原子的半径为a pm,中间的锌原子和底面的三个锌原子构成了正四面体,正四面体的边长为2a,用立体几何的知识求出晶胞的体积,用均摊法求出锌原子个数,进而求出锌晶体的密度。
(1)基态Cr原子的原子序数是24,价电子排布式为3d54s1,则价电子轨道表达式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) 非金属性越强,电负性越大,则CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H;对于碳原子,碳碳单键是sp3杂化,碳碳双键和碳氧双键是sp2杂化,三键是sp杂化,则CH3COOH分子中甲基的饱和碳原子为sp3杂化,羧基的碳原子的轨道杂化类型为sp2;单键都是σ键,双键中含有1个σ键和1个π键,则CH3COOH分子中含由σ键与π键的数目之比为7:1,故答案为:O>C>H;sp3和sp2;7:1;
(3)由Sc3+、Cr3+、Fe2+、Zn2+离子的核外电子排布式分别为1s22s22p63s23p6、1s22s22p63s23p63d2、1s22s22p63s23p63d6、1s22s22p63s23p63d10可知,过渡元素水合离子的颜色与d轨道上未成对电子有关,水合离子为无色的Sc3+的3d轨道上电子为全空、Zn2+的3d轨道上电子为全满,故答案为:3d轨道上没有未成对电子(3d轨道上电子为全空或全满);
(4)Fe[Zn(OH)Cl2]2的水溶液中存在Fe2+和[Zn(OH)Cl2]—离子, [Zn(OH)Cl2]-离子中存在共价键、配位键,水分子间还有范德华力和氢键,则溶液中不存在离子键和金属键;[Zn(OH)Cl2]-中Zn提供空轨道,氯原子和氧原子提供孤对电子,则溶液中[Zn(OH)Cl2]-的结构式为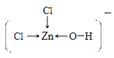 或
或 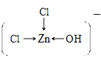 ,故答案为:AC;
,故答案为:AC;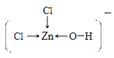 或
或 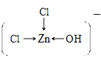 ;
;
(5)根据图1锌的堆积方式图可知,锌的堆积方式为六方最密堆积,最密堆积的配位数为12,故答案为:六方最密堆积;12;
![]() +1=2,则晶胞质量为
+1=2,则晶胞质量为![]() g,若锌原子的半径为a pm,中间的锌原子和底面的三个锌原子构成了正四面体,正四面体的边长为2a pm,则晶胞的底面积是2apm×(2a×sin60°)pm=
g,若锌原子的半径为a pm,中间的锌原子和底面的三个锌原子构成了正四面体,正四面体的边长为2a pm,则晶胞的底面积是2apm×(2a×sin60°)pm=![]() 2 pm2,晶胞的高为
2 pm2,晶胞的高为![]() pm=
pm=![]() pm ,体积是
pm ,体积是![]() 2 pm2×
2 pm2×![]() pm=
pm=![]() 3 pm3,由此可知晶胞的密度为
3 pm3,由此可知晶胞的密度为![]() ,故答案为:
,故答案为:![]() 或
或![]() 。
。

 优学名师名题系列答案
优学名师名题系列答案