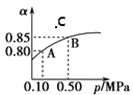
题目内容
【题目】已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图所示。试回答:
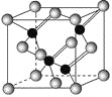
(1)镓的基态原子的电子排布式是______。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为___,与同一个镓原子相连的砷原子构成的空间构型为____。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是___ (用氢化物分子式表示)。
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为____。
(5)比较二者的第一电离能:As____Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是__(填字母)。
A.砷化镓晶胞结构与NaCl相同 B.电负性:As>Ga C.砷化镓晶体中含有配位键
【答案】1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1) 4 正四面体 NH3>AsH3>PH3 sp2 > BC
【解析】
(1)镓是31号元素,其原子核外有31个电子,根据构造原理书写其基态原子核外电子排布式;
(2)根据砷原子的位置,利用均摊法分析晶胞的结构;
(3)从氢键以及影响分子间作用力的因素比较氢化物熔沸点的高低;
(4)根据价层电子对数计算杂化类型;
(5)同周期元素从左到右,元素的第一电离能逐渐增大,
(6)从晶体类型以及原子结构的角度分析.
(1)镓位于周期表中第四周期第IIIA,故其核外电子排布式为1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1),
故答案为:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);
(2)根据“均摊法”:白色球个数为6×12+8×18)=4.由晶胞图可知与同一个镓原子相连的砷原子构成的空间构型为正四面体,故答案为:4;正四面体;
(3)由于NH3分子间存在氢键,所以NH3的沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的沸点高于PH3,
故答案为:NH3>AsH3>PH3;
(4)由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,故答案为: sp2;
(5)As和Ga处于同一周期,而处于VA的As外围电子处于半满的较稳定结构,故As的第一电离能大于Ga,
故答案为:>;
(6)A.NaCl晶体中阴阳离子的配位数为6,而砷化镓晶胞中中阴阳离子的配位数为8,二者晶体结构不同,故A错误;
B. 周期表同周期元素从左到右元素的电负性逐渐增大,则As>Ga,故B正确;
C .由于Ga原子最外层只有3个电子,而每个Ga原子与4个As原子成键,因此其中一个共价键必为配位键,故C正确。
故答案为:BC

【题目】化学与生活密切相关。
I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为__。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为__,碳原子的轨道杂化类型为__,所含σ键与π键的数目之比为__。
(3)已知Cr3+等过渡元素水合离子的颜色如表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为__。
II.ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有__(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为__。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为__,配位数为__。
(6)若锌原子的半径为apm,阿伏加德罗常数的值为NA,则锌晶体的密度为___g/cm3(用含a的代数式表示)。
【题目】下列“解释或结论”与“实验操作及现象”不相符的一组是
序号 | 实验操作及现象 | 解释或结论 |
A | 浓硫酸滴到纸张上,纸变黑 | 浓硫酸有脱水性 |
B | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和 漂白性物质 |
C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定有CO32- |
D | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
A.AB.BC.CD.D