题目内容
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。
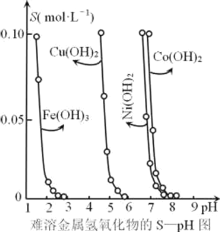
(1)pH=6时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____(选填序号)。
A.<2 B. 3.54.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
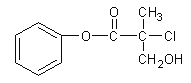
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______.
已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______(选填序号)。
A.NaOH B.FeS C.Na2S
【答案】Cu(OH)2 B 不能 Ni2+与Co2+沉淀完全时的pH相差很小 ![]() B
B
【解析】
1)在pH=6时,溶液中不会出现Cu(OH)2沉淀;
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右;
(3)Co2+和Ni2+沉淀的pH范围相差太小;
(4)根据反应物和生成物可写出反应的方程式;
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子。
(1)由图可知,在pH=6时,溶液中出现Cu(OH)2沉淀,主要以Cu(OH)2存在,
故答案为:Cu(OH)2;
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右Fe3+沉淀完全,
故答案为:B;
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,无法控制溶液的pH,
故答案为:不能;Ni2+与Co2+沉淀完全时的pH相差很小;
(4)氢氧化铜沉淀溶于氨水生成![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子,
故答案为:B。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化