��Ŀ����
����Ŀ��������Ʒ�������п�����������������Ʒ�ı�������һ�����ܵ�Fe3O4��ijѧϰС��Ϊ���о�������Ƭ���ֱ����������ʵ�������
�ٰ�һ����������Ƭ�ӹ��ɾ��ȷ�ĩ��
��ȡm g�÷�ĩ������28.00 mL 1 mol/L�������У�ǡ����ȫ��Ӧ�����ɱ�״���µ�����134.4 mL������Һ�е���KSCN��Һ������������
����ȡ���ݲ�ͬ�����ķ�ĩ���ּӼӵ���ͬ���(V)�����ʵ���Ũ�Ⱦ�Ϊl0.00 mol/L������������Һ�У���ַ�Ӧ����ȫ���ܽ⣬�йص�ʵ���������±���ʾ(����NO�������Ψһ��ԭ����)��
ʵ����� | �� | �� | �� |
�����ĩ����/g | 13.68 | 27.36 | 34.20 |
����������������״����/L | 2.912 | 5.824 | 6.720 |
������и��⣺
��1��ʵ���������Һ�е�������_______(д��ѧʽ)����Ʒ��n(Fe)��n(Fe3O4)=________��m��____________��
��2������ʵ�����ÿ��������Һ�����(V)��mL��_________��
��3������ʵ���������Һ�м�������ͭ�ۣ�Ҫʹ��Һ��Cu2ʮ��Fe2+��Fe3+ͬʱ���ڣ������ͭ�۵����ʵ����ķ�Χ___________��
���𰸡�FeCl2 4��1 0.912 g 180 mL 0.105mol��n(Cu)��0.315mol
��������
��1����������Һ�е���KSCN��Һ�������������֪��Ӧ�����ɵ�����ΪFeCl2�����ڷ����������Ϊ28.00 mL�� 1 mol/L=0.028mol���ʲ���FeCl2�����ʵ���Ϊ0.028/2=0.014mol�����е������ֱ������ᡢFe3O4���߷�����Ӧ���������ɱ�״���µ�����134.4 mL(0.006mol)�����ݵ���غ��֪��������������ᷢ����������ĵ�����Ϊ0.006mol����Fe3O4��Fe��HCl��ͬ��Ӧ���ڸ÷�Ӧ����Ԫ������Ϊ��0.014mol-0.006mol=0.008mol���Ҹ÷�Ӧ����ʽΪFe3O4+8HCl+Fe=4FeCl2+4H2O��ͨ���÷�Ӧ����ʽ��֪Fe3O4Ϊ0.002mol�������÷�Ӧ�ĵ�����Ϊ0.002mol�����ܵ�Fe���ʵ���Ϊ0.008mol��Fe3O4Ϊ0.002mol���ʱ���Ϊ4��1������Ϊ0.002mol��232g/mol +0.008mol��56g/mol =0.912g��
��2����������ʵ�飬ͨ��Ͷ���ĩ�����������������������ϵ��֪����Ϊ�����������Ϊ��ĩ��������ͨ��ʵ��������������������ڼ���NO�������Ψһ��ԭ����Ҳ�������������ʵ���Ϊ6.720L/22.4L��mol-1=0.3mol����NԪ�صõ�������Ϊ0.3mol��3=0.9mol�����ڢ��л��������Ϊ34.2g����n(Fe)��n(Fe3O4)=4:1����FeΪ0.3mol��Fe3O4Ϊ0.075mol�����ڵ�Ԫ�صõ���������Ϊ0.9mol������Һ��ΪFe(NO3)2��Fe(NO3)3�������ʣ������֪Fe(NO3)2Ϊ0.075mol��Fe(NO3)3Ϊ0.45mol������Һ�����������Ϊ0.075mol��2+0.45mol��3=1.5mol����÷�Ӧ��NԪ�������ʵ���Ϊ1.5mol+0.3mol=1.8mol������������Ϊ180mL��
��3��27.36g ��ĩ������n(Fe)��n(Fe3O4)=4:1��֪����Ԫ��0.42mol�������������������Ϊ����������II��Ӧ��������1.52 mol(���Ṳ1.8mol)����II��Һ����Fe3+0.42 mol����������0.28mol��

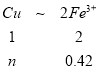
nmin=0.105mol n=0.21mol nmax =0.21mol+0.105mol=0.315mol���ʴ�Ϊ��0.105mol��n(Cu)��0.315mol��

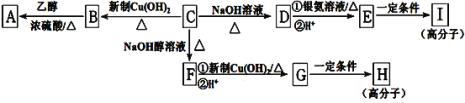
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ͨ����н�������ʵ�飺
���� |
|
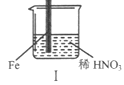
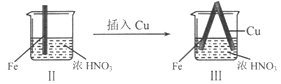
| |
���� | Fe�������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ | Fe���������������ɫ���ݺ�Ѹ��ֹͣ | Fe��Cu�Ӵ�����������������ɫ���� |
����˵������ȷ����
A. I����������ɫ�����ɫ�Ļ�ѧ����ʽ��2NO+O2��2NO2
B. II�е�����˵��Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ
C. �Ա�I��II������˵��ϡHNO3��������ǿ��ŨHNO3
D. ��Ԣ���������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ�����