题目内容
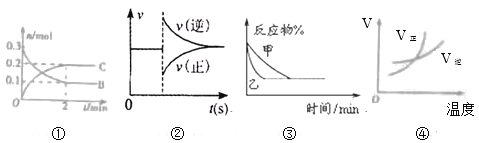
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
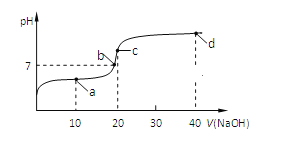
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
【答案】B
【解析】
a点为20mL 0.1mol/L的CH3COOH溶液中滴加10mL 0.1mol/L的NaOH溶液,溶质是等浓度的CH3COONa、CH3COOH,此时溶液呈酸性,说明醋酸电离大于水解,所以c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故A正确;
B. 根据电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+c(OH-) >,b点溶液呈中性,所以c(Na+)=c(CH3COO-),故B错误;
C. c点为20mL 0.1mol/L的CH3COOH溶液中滴加20mL 0.1mol/L的NaOH溶液,溶质是CH3COONa,根据质子守恒:c(OH-)=c(CH3COOH)+ c(H+),故C正确;
D. d点为20mL 0.1mol/L的CH3COOH溶液中滴加40mL 0.1mol/L的NaOH溶液,溶质是等浓度的CH3COONa、NaOH,由于CH3COONa发生微弱水解,所以c(OH-) > c(CH3COO-), c(Na+)>c(OH-) > c(CH3COO-)>c(H+),故D正确;选B。

 阅读快车系列答案
阅读快车系列答案【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
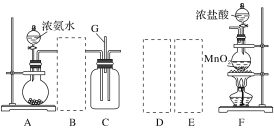
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________