题目内容
【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D
【答案】D
【解析】
根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=σ键个数+孤电子对数。
A.SO2分子中心原子S的孤电子对数=![]() ×(6-2×2)=1,价层电子对数=2+1=3,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,去除孤电子对,分子的立体构型为V型结构,A错误;
×(6-2×2)=1,价层电子对数=2+1=3,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,去除孤电子对,分子的立体构型为V型结构,A错误;
B. H2O分子中心原子O的孤电子对数=![]() ×(6-2×1)=2,价层电子对数=2+2=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为V型结构,B错误;
×(6-2×1)=2,价层电子对数=2+2=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为V型结构,B错误;
C. NH3分子中心原子N的孤电子对数=![]() ×(5-3×1)=1,价层电子对数=3+1=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为三角锥形,C错误;
×(5-3×1)=1,价层电子对数=3+1=4,杂化方式sp3杂化,价层电子对互斥模型为四面体形,去除孤电子对,分子的立体构型为三角锥形,C错误;
D.CH4分子中心原子C的孤电子对数=![]() ×(4-4×1)=0,价层电子对数=4+0=4,杂化方式sp3杂化,价层电子对互斥模型为正四面体形,分子的立体构型为正四面体形,D正确。
×(4-4×1)=0,价层电子对数=4+0=4,杂化方式sp3杂化,价层电子对互斥模型为正四面体形,分子的立体构型为正四面体形,D正确。
答案选D。

【题目】对氯苯氧乙酸是一种具有生长素活性的苯氧类植物生长调节剂。实验室合成原理为:![]() +ClCH2COOH+2NaOH
+ClCH2COOH+2NaOH![]() +NaCl+H2O
+NaCl+H2O
![]() +HCl
+HCl![]() +NaCl
+NaCl
制备过程存在副反应:ClCH2COOH+2NaOH![]() HOCH2COONa+NaCl+H2O
HOCH2COONa+NaCl+H2O
已知相关物质的物理性质:
名称 | 氯乙酸 | 对氯苯酚 | 对氯苯氧乙酸 |
性状 | 无色晶体 | 无色晶体 | 白色晶体 |
水 | 易溶 | 极微溶 | 微溶 |
乙醇 | 易溶 | 溶 | 易溶 |
乙醚 | 易溶 | 溶 | 易溶 |
主要实验装置和步骤如下:

Ⅰ.合成:在三颈烧瓶中加入10mL20%的NaOH溶液、6.4g对氯苯酚和0.5gKI。称取5.3g氯乙酸溶于蒸馏水并移入c中,在a中加入15mL20%的NaOH溶液。加热和搅拌装置,然后慢慢滴加氯乙酸和NaOH溶液,滴加完毕后继续搅拌加热半小时。反应结束后,趁热将反应液倒入烧瓶中,加盐酸至pH为1左右,用冰水冷却使晶体析出,抽滤,洗涤,得粗产品。
Ⅱ.提纯
粗产品![]() 滤液
滤液![]() 少量固体析出
少量固体析出![]()
回答下列问题:
(1)d处应接的装置是__。
(2)合成过程中要在不断搅拌下滴加氯乙酸和NaOH溶液的原因是__。
(3)试剂X是__。
(4)趁热过滤除去的杂质的化学式是__。
(5)提纯步骤中,洗涤抽滤得到的晶体应选用的洗涤剂是__。
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
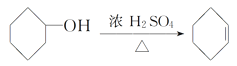 +H2O
+H2O

可能用到的有关数据如下:
相对分子质量 | 密度/ g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%