题目内容
【题目】氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN-等形式存在于废水中。某化学小组同学对含氰化物废水处理进行研究。
Ⅰ.查阅资料:含氰化物的废水处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
Ⅱ.实验验证:处理CN-的效果。
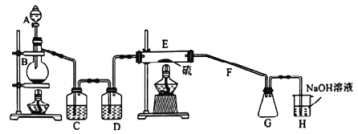
化学兴趣小组的同学在密闭系统中用如图装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
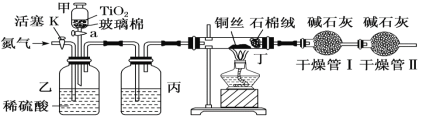
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN-的废水与过量NaClO溶液的混合液共200 mL(设其中CN-的浓度为0.2 mol·L-1)倒入甲中,塞上橡皮塞。
步骤3:点燃酒精灯对丁装置加热。
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管Ⅰ(含碱石灰)的质量m2[实验前干燥管Ⅰ(含碱石灰)的质量m1]。
回答下列问题:
(1)在处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式为:___________。
(2)对丁装置加热放在步骤3进行的原因是:___________。
(3)丙装置中的试剂是:___________。
(4)装置中石棉绒作用为:___________。
(5)干燥管Ⅱ的作用是:_____________________________。
(6)请简要说明实验中通入N2的目的是:______________________________。
(7)若干燥管Ⅰ中碱石灰增重1.408 g,则该实验中测得CN-被处理的百分率为:_______。
【答案】2CNO-+6ClO-+8H+=2CO2↑+N2↑+3Cl2↑+4H2O 将产生的氯气及时除去 浓硫酸 防止堵塞导管 防止空气中的水和CO2进入干燥管Ⅰ中影响对CO2的测量 使装置中的CO2全部被排到干燥管Ⅰ中被吸收,减少误差 80%
【解析】
(1)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应电子守恒标注电子转移;
(2)装置丁的作用是加热利用铜与氯气反应,除去乙中反应生成的气体中混有的氯气,防止干燥管Ⅰ吸收氯气,影响二氧化碳质量的测定;
(3)实验原理为测量干燥管Ⅰ吸收的二氧化碳的质量确定对CN-的处理,由于乙装置中产生N2、CO2、Cl2、H2O,氯气与水都能被碱石灰吸收,影响二氧化碳质量的测定,所以进入干燥管Ⅰ的气体应除去氯气与水,用浓硫酸吸水,用铜网除去氯气,故丙装置的试剂是浓硫酸;
(4)石棉绒表面积大,比较蓬松,能够防止固体小颗粒堵塞导气管;
(5)在实验过程中应防止空气中的CO2、水蒸气进入干燥管Ⅰ干扰实验,影响二氧化碳质量的测定;
(6)装置中残留有CO2未被完全吸收,导致测定的二氧化碳质量偏低;
(7)干燥管Ⅰ中碱石灰增重1.408 g为二氧化碳的质量,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2),原溶液中CN-的物质的量为0.2 L×0.2 mol/L=0.04 mol,据此计算。
(1)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为:2CNO-+6ClO-+8H+=2CO2↑+N2↑+3Cl2↑+4H2O;
(2)加热装置丁的作用是除去反应生成的氯气;
(3)实验原理为测量干燥管Ⅰ吸收的二氧化碳的质量确定对CN-的处理,由于乙装置中产生N2、CO2、Cl2、H2O,氯气与水都能被碱石灰吸收,影响二氧化碳质量的测定.所以进入干燥管Ⅰ的气体应除去氯气与水,用浓硫酸吸水,用铜网除去氯气,故丙装置中的试剂是浓硫酸;
(4)石棉绒表面积大,比较蓬松,能够防止Cu与Cl2反应产生CuCl2固体小颗粒堵塞导气管;
(5)干燥管Ⅰ的作用是吸收CO2,测定生成的CO2的质量,空气中的CO2、水蒸气进入干燥管Ⅰ干扰实验,所以干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干燥管I中影响对CO2的测量;
(6)装置中残留有CO2未被完全吸收,导致测定的二氧化碳质量偏低,通入N2使装置中的CO2全部被排到干燥管I中被吸收,减少误差;
(7)干燥管Ⅰ中碱石灰增重1.408 g为二氧化碳的质量,其物质的量n(CO2)=![]() =0.032 mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量n(CN-)总=0.2 L×0.2 mol/L=0.04 mol,故该实验中测得CN-被处理的百分率为
=0.032 mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量n(CN-)总=0.2 L×0.2 mol/L=0.04 mol,故该实验中测得CN-被处理的百分率为![]() ×100%=80%。
×100%=80%。

 阅读快车系列答案
阅读快车系列答案