题目内容
14.下列离子方程式,一定正确的是( )| A. | 硫化亚铁与稀硝酸反应:FeS+2H+→Fe2++H2S | |
| B. | 纯碱溶液中滴加少量盐酸:CO32-+H+→HCO3- | |
| C. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O | |
| D. | 将少量SO2气体通入Ca(ClO)2溶液中:SO2+Ca2++2ClO-+H2O→CaSO3↓+2HClO |
分析 A、硫化氢具有还原性被稀硝酸氧化,生成硝酸铁、S、NO和水;
B、碳酸钠与少量盐酸反应生成碳酸氢钠和氯化钠,离子方程式书写方法解答;
C、硫酸氢钠与氢氧化钡按照物质的量2:1进行反应;
D、向漂白粉溶液中通入少量SO2气体反应生成硫酸钙、氯化氢和次氯酸.
解答 解:A、硫化亚铁与稀硝酸反应的离子反应为NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故A错误;
B、碳酸钠与少量盐酸反应的化学方程式:Na2CO3+HCl(少量)=NaCl+NaHCO3,离子方程式为:CO32-+H+=HCO3-,故B正确;
C、硫酸氢钠与氢氧化钡按照物质的量2:1进行反应,满足氢离子与氢氧根离子的物质的量相等,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C正确;
D、向漂白粉溶液中通入少量SO2气体反应生成硫酸钙、氯化氢和次氯酸,离子方程式为:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO,故D错误;
故选BC.
点评 本题考查了离子方程式的书写,题目难度不大,熟悉反应的实质是解题关键,注意离子方程式遵循质量守恒、电荷守恒定律.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
4.只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液,这种试剂是( )
| A. | 氢氧化钠溶液 | B. | 氢氧化铜悬浊液 | C. | 石蕊试液 | D. | 碳酸钠溶液 |
5.下列化学用语表示正确的是( )
| A. | 乙酸的分子式 CH3COOH | B. | OH-的电子式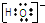 | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | 氯原子的结构示意图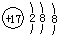 |
2.下列离子方程式正确的是( )
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH-$\stackrel{△}{→}$CH2ClCOO-+H2O | |
| C. | 用新制氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O | |
| D. | 苯酚钠溶液中通入少量二氧化硫:C6H5O-+SO2+H2O→C6H5OH+HSO3- |
19.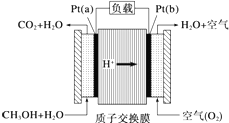 科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
 科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )| A. | a 是负极,b 是正极 | |
| B. | b 极的电极反应是 O2+4H++4e-═2H2O | |
| C. | 放电过程中,电子流动方向为:a→b→质子交换膜→a | |
| D. | 当电路上通过 2 mol 电子消耗的 CH3OH 为 $\frac{1}{3}$mol |
8.设NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为$\frac{{N}_{A}}{22.4}$ |
9.下列说法正确的是( )
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
 ,该元素的名称是氧;
,该元素的名称是氧; 如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题: