题目内容
9.下列说法正确的是( )| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
分析 A.醋酸是弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离;
B.NaHA水溶液pH<0时,H2A可能是弱酸也可能是强酸;
C.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸和NaOH的水溶液呈中性,则醋酸应该稍微过量;
D.AgCl难溶液水,在水溶液中存在溶解平衡,如果溶液中含有Ag+或Cl-,会抑制AgCl溶解,硝酸银是可溶性银盐.
解答 解:A.醋酸是弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离,所以常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液中氢原子浓度大于原来的$\frac{1}{10}$,所以该溶液的pH<4,故A错误;
B.NaHA水溶液pH<0时,H2A可能是弱酸也可能是强酸,如NaHSO3溶液pH<7,但H2SO3是弱酸,NaHSO4溶液pH<7,但H2SO4是强酸,故B错误;
C.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸和NaOH的水溶液呈中性,则醋酸应该稍微过量,所以用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,酸有剩余,所以溶液中的酸未被完全中和,故C正确;
D.AgCl难溶液水,在水溶液中存在溶解平衡,如果溶液中含有Ag+或Cl-,会抑制AgCl溶解,
氯离子浓度越大抑制AgCl溶解程度越大,硝酸银是可溶性银盐,银离子浓度最大,所以这几种溶液中Ag+浓度:④>①>②>③,故D错误;
故选C.
点评 本题考查弱电解质的电离及离子浓度大小比较等知识点,明确弱电解质电离特点及难溶物溶解平衡影响因素是解本题关键,易错选项是D,注意:虽然硝酸银抑制AgCl溶解,但硝酸银是可溶性物质,题目难度中等.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
14.下列离子方程式,一定正确的是( )
| A. | 硫化亚铁与稀硝酸反应:FeS+2H+→Fe2++H2S | |
| B. | 纯碱溶液中滴加少量盐酸:CO32-+H+→HCO3- | |
| C. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O | |
| D. | 将少量SO2气体通入Ca(ClO)2溶液中:SO2+Ca2++2ClO-+H2O→CaSO3↓+2HClO |
20.丙烯酸(CH2=CH-COOH)的性质可能有( )
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
| A. | ①③④ | B. | ①③④⑤⑥ | C. | ①③⑥ | D. | ①②③④⑤ |
4.在0.1mol•L-1的NaHCO3溶液中,下列关系正确的是( )
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
14.烷烃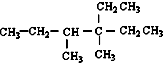 是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
 是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )| A. | 3种 | B. | 4 | C. | 5种 | D. | 6种 |
1.下列说法正确的是( )
| A. | 除去Cu2+中的少量Fe3+,可加入CuO | |
| B. | 沸点:晶体硅>SiO2>SiCl4>NaCl | |
| C. | Cu(NH3)${\;}_{4}^{2+}$中的配位键是由Cu2+提供孤对电子,NH3提供空轨道形成的 | |
| D. | 石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化 |
18.标准状况下将35mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140mL,则该烃的分子式为( )
| A. | C5H12 | B. | C4H10 | C. | C3H6 | D. | C3H8 |
19.天然产物水有关解的叙述不正确的是( )
| A. | 油脂水解可得到丙三醇 | |
| B. | 可用碘检验淀粉是否发生水解 | |
| C. | 蛋白质水解的最终产物均为氨基酸 | |
| D. | 纤维素水解与淀粉水解得到的最终产物相同 |
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: