题目内容
8.设NA为阿伏加德罗常数,下列有关说法正确的是( )| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为$\frac{{N}_{A}}{22.4}$ |
分析 A、乙烯和丙烯的最简式相同,碳的质量分数相同,计算碳元素的质量,再计算碳原子数目;
B、苯分子中不含C=C双键;
C、1个甲基(-CH3)含有9个电子;
D、甲醇标准状况不是气体.
解答 解:A、2.8g乙烯和丙烯的混合气体中碳元素的质量为2.8g×$\frac{12}{14}$=2.4g,所含碳原子数目为$\frac{2.4g}{12g/mol}$×NAmol-1=0.2NA,故A正确;
B、苯分子中不含C=C双键,故B错误;
C、1个甲基(-CH3)含有9个电子,所以1mol甲基(-CH3)所含的电子总数为9NA,故C错误;
D、标准状况下甲醇不是气体,故D错误;
故选A.
点评 本题考查常用化学计量的有关计算,难度较小,注意D中利用乙烯和丙烯的最简式相同,碳的质量分数相同,利用平均量计算.

练习册系列答案
相关题目
13.往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸后,溶液的颜色( )
| A. | 逐渐变浅 | B. | 变深绿色 | C. | 变棕黄色 | D. | 没有变化 |
14.下列离子方程式,一定正确的是( )
| A. | 硫化亚铁与稀硝酸反应:FeS+2H+→Fe2++H2S | |
| B. | 纯碱溶液中滴加少量盐酸:CO32-+H+→HCO3- | |
| C. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O | |
| D. | 将少量SO2气体通入Ca(ClO)2溶液中:SO2+Ca2++2ClO-+H2O→CaSO3↓+2HClO |
13.下列各组中的性质比较,正确的是( )
| A. | 酸性HClO4>HBrO4>HIO4 | B. | 碱性NaOH>Mg(OH)2>Ca(OH)2 | ||
| C. | 稳定性:HI>H2S>HCl | D. | 氧化性:Na+>Mg2+>Al3+ |
20.丙烯酸(CH2=CH-COOH)的性质可能有( )
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
| A. | ①③④ | B. | ①③④⑤⑥ | C. | ①③⑥ | D. | ①②③④⑤ |
18.标准状况下将35mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140mL,则该烃的分子式为( )
| A. | C5H12 | B. | C4H10 | C. | C3H6 | D. | C3H8 |
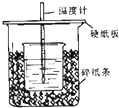 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: