题目内容
【题目】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______离子通过,氯气的逸出口是_______(填标号)。
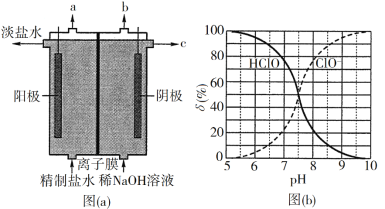
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=![]() ,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____mol;产生“气泡”的化学方程式为____________。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____kg(保留整数)。
【答案】Na+ a 10-7.5 2Cl2+HgO=HgCl2+Cl2O 1.25 NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O ClO-+Cl-+2H+=Cl2↑+ H2O 203
【解析】
(1)电解饱和食盐水,阳极产生氯气,阳离子移向阴极室;
(2)由图pH=7.5时,c(HClO)=c(ClO-),HClO的Ka=![]() =c(H+);
=c(H+);
(3)Cl2歧化为Cl2O和Cl-;
(4)根据5ClO2-+4H+=4ClO2+Cl-+2H2O,计算每生成1molClO2,消耗的NaClO2;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳;
(5)“84”中的NaClO、NaCl和酸性清洁剂混合后发生归中反应;根据NaOH质量守恒计算;
(1)电解饱和食盐水,反应的化学方程式为2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,阳极氯离子失电子发生氧化反应生成氯气,氯气从a口逸出,阴极氢离子得到电子发生还原反应生成氢气,产生OH-与通过离子膜的Na+在阴极室形成NaOH,故答案为:Na+;a;
2NaOH+Cl2↑+H2↑,阳极氯离子失电子发生氧化反应生成氯气,氯气从a口逸出,阴极氢离子得到电子发生还原反应生成氢气,产生OH-与通过离子膜的Na+在阴极室形成NaOH,故答案为:Na+;a;
(2)由图pH=7.5时,c(HClO)=c(ClO-),HClO的Ka=![]() =c(H+)=10-7.5;故答案为:10-7.5;
=c(H+)=10-7.5;故答案为:10-7.5;
(3)Cl2歧化为Cl2O和Cl-,HgO和氯气反应的方程式为:2Cl2+HgO=HgCl2+Cl2O,故答案为:2Cl2+HgO=HgCl2+Cl2O;
(4)5ClO2-+4H+=4ClO2+Cl-+2H2O,每生成1molClO2,消耗NaClO2为![]() =1.25mol;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳,方程式为:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑,故答案为:1.25mol;NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑;
=1.25mol;碳酸氢钠和硫酸氢钠反应生成硫酸钠、水和二氧化碳,方程式为:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑,故答案为:1.25mol;NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑;
(5)“84”中的NaClO、NaCl和酸性清洁剂混合后发生归中反应,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O;设氯气为xkg,则消耗的NaOH为![]() kg,原氢氧化钠质量为
kg,原氢氧化钠质量为![]() +1000Kg×0.01,由NaOH质量守恒:原溶液为1000Kg-x,则
+1000Kg×0.01,由NaOH质量守恒:原溶液为1000Kg-x,则![]() Kg+1000Kg×0. 01=(1000Kg-x)×0.3,解得x=203Kg;故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;203。
Kg+1000Kg×0. 01=(1000Kg-x)×0.3,解得x=203Kg;故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;203。

【题目】天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 | C2H6(g) | C2H4(g) | H2(g) |
燃烧热ΔH/( kJ·mol1) | -1560 | -1411 | -286 |
①ΔH=_________kJ·mol1。
②提高该反应平衡转化率的方法有_________、_________。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4![]() C2H6+H2。反应在初期阶段的速率方程为:r=k×
C2H6+H2。反应在初期阶段的速率方程为:r=k×![]() ,其中k为反应速率常数。
,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_____ r1。
②对于处于初期阶段的该反应,下列说法正确的是_________。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
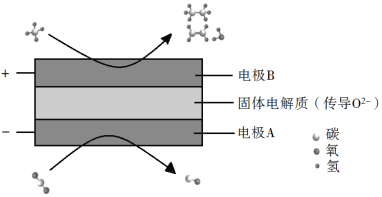
①阴极上的反应式为_________。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为_________。