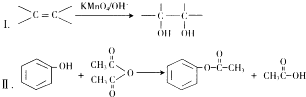
题目内容
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
【答案】C
【解析】A、酸碱中和是放热反应,故△H应为负值,选项A错误;B、燃烧热为1mol H2完全燃烧的热效应,故在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:H2O(l)=H2(g)+ ![]() O2(g) △H = +285.5 kJ·mol-1,选项B错误;C、由反应2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,选项C正确;D、2N2O5(g)
O2(g) △H = +285.5 kJ·mol-1,选项B错误;C、由反应2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,选项C正确;D、2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,△S>0,则高温条件下才有可能满足△H-T△S<0,反应才能自发进行,选项D错误。答案选C。
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,△S>0,则高温条件下才有可能满足△H-T△S<0,反应才能自发进行,选项D错误。答案选C。

 优等生题库系列答案
优等生题库系列答案【题目】根据表中信息,判断下列叙述中正确的是( )
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | / | Cl﹣ | |
② | KClO3 | 浓盐酸 | / | Cl2 | |
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组反应当n(FeBr2):n(Cl2)≥ ![]() 一种元素被氧化、当n(FeBr2):n(Cl2)<
一种元素被氧化、当n(FeBr2):n(Cl2)< ![]() 两种元素被氧化
两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e﹣
D.表中③组反应的离子方程式为:2MnO ![]() +5H2O2+6H+═2Mn2++5O2↑+8H2O
+5H2O2+6H+═2Mn2++5O2↑+8H2O