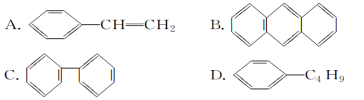题目内容
【题目】(1)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式_______
(2)某炔烃和氢气充分加成生成2,5﹣二甲基己烷,该炔烃的结构简式是_______
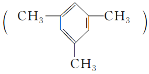
(3)某芳香烃结构为![]() 。它一氯代物有_______种。
。它一氯代物有_______种。
(4)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_______,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_______。
(5) 分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,该芳香烃的结构简式是_______。
【答案】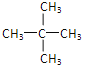 (CH3)2CHC≡CCH(CH3)2 4
(CH3)2CHC≡CCH(CH3)2 4 ![]() CH3C≡CCH3
CH3C≡CCH3 ![]()
【解析】
(1)戊烷的某种同分异构体只有一种一氯代物,说明该有机物分子中只含1种类型的氢原子;
(2)饱和烃与炔烃分子中碳的骨架完全相同,饱和烃相邻碳原子上必须均含有两个或两个以上的氢原子时才可出现碳碳叁键,根据2,5-二甲基己烷确定炔烃的结构简式;
(3)芳香烃的结构简式是![]() ,分子中有4种氢原子;
,分子中有4种氢原子;
(4)根据乙烯是平面型分子,乙炔是直线型分子,分析判断;
(5)分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,说明结构具有对称性,据此分析判断。
(1)戊烷的某种同分异构体只有一种一氯代物,说明该有机物分子中只含1种类型的氢原子,该烃的结构简式为 ,故答案为:
,故答案为: ;
;
(2)饱和烃与炔烃的碳的骨架完全相同,倒推可得,饱和烃相邻碳原子上必须均含有两个或两个以上的氢原子时才可出现碳碳叁键,所以某炔烃和氢气充分加成生成2,5-二甲基己烷,该炔烃的结构简式是(CH3)2CHC≡CCH(CH3)2,故答案为:(CH3)2CHC≡CCH(CH3)2;
(3)芳香烃的结构简式是![]() ,分子中有4种氢原子(
,分子中有4种氢原子(![]() ),所以一氯代物有4种,故答案为:4;
),所以一氯代物有4种,故答案为:4;
(4)乙烯是平面型分子,![]() 可看做乙烯中的四个氢原子被甲基取代,所以分子式为C6H12且所有碳原子都在同一平面上的烃的结构简式为
可看做乙烯中的四个氢原子被甲基取代,所以分子式为C6H12且所有碳原子都在同一平面上的烃的结构简式为![]() ;乙炔是直线型分子,CH3C≡CCH3可看做是甲基取代乙炔分子上的氢原子,所以分子式为C4H6的烃中所有的碳原子都在同一条直线上的结构简式是CH3C≡CCH3,故答案为:
;乙炔是直线型分子,CH3C≡CCH3可看做是甲基取代乙炔分子上的氢原子,所以分子式为C4H6的烃中所有的碳原子都在同一条直线上的结构简式是CH3C≡CCH3,故答案为:![]() ;CH3C≡CCH3;
;CH3C≡CCH3;
(5)分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,说明结构对称,所以结构简式是![]() ,故答案为:
,故答案为:![]() 。
。