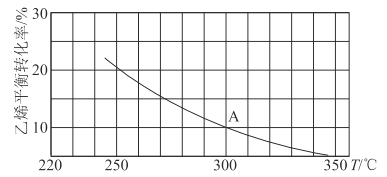
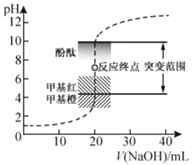
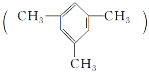
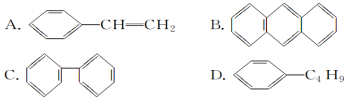题目内容
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和氨水反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
【答案】B
【解析】
A.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和氨水反应生成的水是几摩尔,其中和热都约为-57.3kJ/mol,因为一水合氨为弱碱,电离需要吸热,因此中和热略大于-57.3kJ/mol,故A错误;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,CO(g)的燃烧热是283.0kJ/mol,则热化学方程式为:CO(g)+![]() O2(g)═CO2 (g)△H=-283.0 kJ/mol;所以2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol,故B正确;
O2(g)═CO2 (g)△H=-283.0 kJ/mol;所以2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol,故B正确;
C.大多放热反应需要加热引发条件才能进行,需要加热的反应不一定是吸热反应,故C错误;
D.1mol甲烷燃烧生成液态水和二氧化碳气体所放出的热量就是甲烷燃烧热,不是生成气态水,故D错误;
故选B。

【题目】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
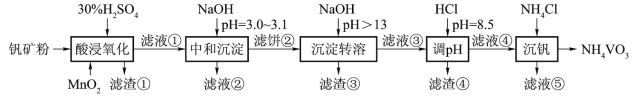
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成![]() ,同时还有___________离子被氧化。写出VO+转化为
,同时还有___________离子被氧化。写出VO+转化为![]() 反应的离子方程式___________。
反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为![]() ,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,![]() 转化为钒酸盐溶解。滤渣③的主要成分是___________。
转化为钒酸盐溶解。滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。