题目内容
13.下列事实能用化学平衡移动原理解释的是( )| A. | 加热或光照时,浓HNO3更易发生分解 | |
| B. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.升高温度,平衡向吸热反应方向移动,硝酸的分解反应是吸热反应,所以加热或光照促进硝酸分解,可以用平衡移动原理解释,故A选;
B.催化剂只改变反应速率但不影响平衡移动,所以不能用平衡移动原理解释,故B不选;
C.浓氨水加入氢氧化钠固体,氢氧化钠固体溶解放热,使一水合氨分解生成氨气的,化学平衡NH3+H2O?NH3•H2O?NH4++OH-,逆向进行,能用化学平衡移动原理解释,故C选;
D.H2、I2生成HI的反应前后气体计量数之和不变,压强不影响该反应平衡移动,增大压强导致气体体积减小,碘浓度增大,则气体颜色加深,不能用平衡移动原理解释,故D不选;
故选AC.
点评 本题考查化学平衡移动原理,为高频考点,明确平衡移动原理内涵是解本题关键,注意平衡移动原理适用范围,易错选项是D.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
15.如图为铜锌原电池示意图,下列说法中正确的是( )


| A. | 锌片逐渐溶解 | B. | 烧杯中溶液逐渐呈蓝色 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 电解质溶液的pH保持不变 |
8.Ⅰ维生素C(C6H8O6)主要存在于蔬菜、水果中,它能增强人体对疾病的抵抗能力.
(1)取三片维生素C,压碎后溶于100mL水中过滤.取少量滤液向其中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈酸性.
(2)维生素C在酸性环境中比较稳定,在高温时易被破坏.请你想一想,如何食用黄瓜,才能充分利用黄瓜中丰富的维生素C?食用黄瓜时最好加点醋凉拌.
Ⅱ某保健食品的外包装标签上的部分内容如下:
(1)该保健食品的主要功能是补钙.
(2)服用后,该保健食品中的碳酸钙与胃液中的盐酸发生反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)食用方法中嚼食的作用是增大反应物的接触面积,促进钙的吸收.
(1)取三片维生素C,压碎后溶于100mL水中过滤.取少量滤液向其中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈酸性.
(2)维生素C在酸性环境中比较稳定,在高温时易被破坏.请你想一想,如何食用黄瓜,才能充分利用黄瓜中丰富的维生素C?食用黄瓜时最好加点醋凉拌.
Ⅱ某保健食品的外包装标签上的部分内容如下:
| 主要原料:碳酸钙 食用方法:每日一次,每次一片,嚼食. |
(2)服用后,该保健食品中的碳酸钙与胃液中的盐酸发生反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)食用方法中嚼食的作用是增大反应物的接触面积,促进钙的吸收.
18.由CO、H2和O2组成的混合气体,在一定条件下恰好完全反应,测得生成物在101kPa、120℃下对空气的相对密度为1.293,则原混合气体中CO所占体积分数为( )
| A. | $\frac{1}{3}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{2}$ | D. | $\frac{1}{6}$ |
5.下表是元素周期表的一部分,请回答有关问题:
(1)表中能形成两性氧化物的元素所形成的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)用电子式表示④元素与⑦元素形成的化合物形成过程 .该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).
.该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).
(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第三周期ⅣA族
(6)①、②的最简单氢化物中稳定性比较强的是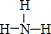 (填结构式).
(填结构式).
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)用电子式表示④元素与⑦元素形成的化合物形成过程
 .该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).
.该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第三周期ⅣA族
(6)①、②的最简单氢化物中稳定性比较强的是
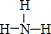 (填结构式).
(填结构式).
3.某元素X的核外电子数等于核内中子数.取该元素单质2.8g与氧气充分作用,可得到6g化合物XO2.该元素在周期表中的位置是( )
| A. | 第四周期 | B. | 第二周期 | C. | 第ⅣA主族 | D. | 第ⅤA主族 |
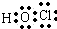 .家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O
.家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O .
. 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: