题目内容
5.下表是元素周期表的一部分,请回答有关问题:主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)用电子式表示④元素与⑦元素形成的化合物形成过程
 .该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).
.该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第三周期ⅣA族
(6)①、②的最简单氢化物中稳定性比较强的是
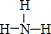 (填结构式).
(填结构式).
分析 由元素在元素周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)能形成两性氧化物的元素所形成的单质为Al,⑨最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与氢气;
(2)④元素与⑦元素形成的化合物为MgCl2,属于离子化合物;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)③元素与⑩元素两者核电荷数之差为第三周期、第四周期容纳元素种数之和;
(5)用于半导体材料的元素为Si;
(6)非金属性越强,对应氢化物越稳定.
解答 解:由元素在元素周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)能形成两性氧化物的元素所形成的单质为Al,⑨最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与氢气,反应离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)④元素与⑦元素形成的化合物为MgCl2,用电子式表示形成过程为 ,属于离子化合物;
,属于离子化合物;
故答案为: ;离子化合物;
;离子化合物;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:F<Cl<S,故答案为:F<Cl<S;
(4)③元素与⑩元素两者核电荷数之差为第三周期、第四周期容纳元素种数之和,即二者原子序数相差8+18=26,故答案为:26;
(5)用于半导体材料的元素为Si,位于周期表中第三周期ⅣA族,故答案为:第三周期ⅣA族;
(6)非金属N>C,非金属性越强,对应氢化物越稳定,故NH3较稳定,其结构式为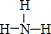 ,故答案为:
,故答案为: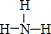 .
.
点评 本题考查元素周期表与元素周期律应用,比较基础,注意理解掌握电子式表示化学键或物质的形成.

 名校课堂系列答案
名校课堂系列答案| A. |  向pH=13的NaOH溶液中不断加水稀释 | |
| B. | 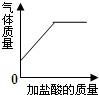 向碳酸氢钠溶液中逐滴加入稀盐酸至过量 | |
| C. | 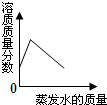 将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. | 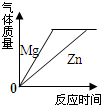 将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合 |
| A. | 加热或光照时,浓HNO3更易发生分解 | |
| B. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
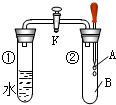 如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )| A. | 苯和氢气 | B. | 稀硫酸与一氧化碳 | ||
| C. | 饱和食盐水与氯气 | D. | 浓溴水和乙烯 |
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,逆反应速率减小 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O |
| A. | 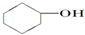 | B. |  | C. |  | D. | CH3CH2CH |
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: 如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )