题目内容
3.某元素X的核外电子数等于核内中子数.取该元素单质2.8g与氧气充分作用,可得到6g化合物XO2.该元素在周期表中的位置是( )| A. | 第四周期 | B. | 第二周期 | C. | 第ⅣA主族 | D. | 第ⅤA主族 |
分析 根据单质和氧气的反应确定单质的相对分子质量进而确定元素原子的相对原子质量,相对原子质量在数值上等于质量数,据A=Z+N来确定质子数,确定元素原子的核外电子排布以确定该元素在周期表中的位置.
解答 解:元素单质2.8克与氧气充分作用,可得到6克化合物XO2,据原子守恒,X~XO2,设元素的相对原子质量为M,故有:$\frac{2.8g}{Mg/mol}=\frac{6g}{(32+M)g/mol}$,解得:M=28核外电子数等于核内中子数等于14,故该元素为硅,位于第三周期,第ⅣA族.
故选:C.
点评 本题考查学生相对原子质量的计算和原子结构决定元素的位置知识,难度不大.

练习册系列答案
相关题目
13.下列事实能用化学平衡移动原理解释的是( )
| A. | 加热或光照时,浓HNO3更易发生分解 | |
| B. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
14.高温下,某反应达平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,逆反应速率减小 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O |
15.下列物质中既属于芳香化合物又属于醇的是( )
| A. | 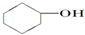 | B. |  | C. |  | D. | CH3CH2CH |
12.有机电合成是合成一系列重要有机化合物的“绿色合成法”.例如利用电合成方法可制取一种无毒、环保性能优异、用途广泛的化工原料碳酸二甲酯.碳酸二甲酯的资料如表,电解制备模拟装置如图:
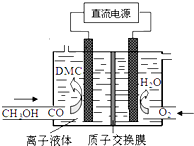 则下列说法正确的是( )
则下列说法正确的是( )
| 碳酸二甲酯资料 | |||||
| 简称 | 键线式 | 熔点 | 沸点 | 化学性质 | 用途 |
| DMC |  | 4℃ | 90.1℃ | 非常活泼、很易水解 毒性很低 | 有机合成中间体 |
 则下列说法正确的是( )
则下列说法正确的是( )| A. | 通O2区是阴极区,质子通过交换膜从阴极区移向阳极区 | |
| B. | 阳极反应:CO-2e-+2CH3OH═(CH3O)2CO+2H+ | |
| C. | 离子液体必须是水溶液,目的是传递电荷 | |
| D. | 电合成DMC的总反应方程式:CO+2CH3OH═(CH3O)2CO+H2 |
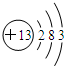 ②S2-
②S2-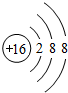
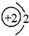 、O
、O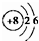 、Ca
、Ca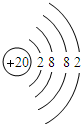 .
.