题目内容
18.由CO、H2和O2组成的混合气体,在一定条件下恰好完全反应,测得生成物在101kPa、120℃下对空气的相对密度为1.293,则原混合气体中CO所占体积分数为( )| A. | $\frac{1}{3}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{2}$ | D. | $\frac{1}{6}$ |
分析 CO、H2和O2组成的混合气体在一定条件下恰好完全反应,生成CO2和H2O,在101kPa,120℃下对空气的相对密度为1.293,则混合气体的平均相对分子质量为1.293×29=37.50,根据平均相对分子质量可计算CO2与H2O的物质的量的比值,进而计算原混合气体中CO所占的体积分数.
解答 解:CO、H2和O2组成的混合气体在一定条件下恰好完全反应,生成CO2和H2O,在101kPa,120℃下对空气的相对密度为
1.293,则混合气体的平均相对分子质量为1.293×29=37.50,
设CO2的物质的量为xmol,H2O的物质的量为ymol,
则$\frac{44x+18y}{x+y}$=37.50,
x:y=3:1,即n(CO2):n(H2O)=3:1,
根据C、H、O 元素质量守恒,得到,反应物中,CO、H2、O2的体积比分别为3:1:2,
则原混合气体中CO所占的体积分数为:$\frac{3}{3+1+2}$=$\frac{1}{2}$,
故选C.
点评 本题考查混合物的计算,题目难度中等,本题注意根据对空气的相对密度计算混合气体的平均相对分子质量,计算CO2与H2O的物质的量的比值,注意题中在一定条件下恰好完全反应的要求.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
20.已知1molR2-中含质子16mol,一定质量的R2-中共含质子8mol,则其中所含的电子的物质的量为( )
| A. | 10 mol | B. | 9 mol | C. | 8 mol | D. | 7 mol |
6.按要求回答以下问题:
(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大.X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素.W、Q是第四周期元素,其中Q元素的核电荷数为29.W原子核外未成对电子数在同周期中最多.
①Y元素在周期表中的位置为第二周期VA族;其轨道表示式为 .
.
②X、Y、Z元素的第一电离能由大到小的顺序为N>O>C(用元素符号作答),X与Z形成三原子分子的电子式为 (用相关的化学用语作答).
(用相关的化学用语作答).
③Y的氢化物沸点<Z的氢化物的沸点(填“>”“<”或“=”).
④基态W原子的外围电子排布式为3d54s1.
⑤Q的氢化物的晶胞结构如图1所示,其化学式是CuH.
(2)过渡元素在生活、生产和科技等方面有广泛的用途.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如3-图丙所示.晶胞中铂(Pt)原子的配位数数为为12.

(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大.X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素.W、Q是第四周期元素,其中Q元素的核电荷数为29.W原子核外未成对电子数在同周期中最多.
①Y元素在周期表中的位置为第二周期VA族;其轨道表示式为
 .
.②X、Y、Z元素的第一电离能由大到小的顺序为N>O>C(用元素符号作答),X与Z形成三原子分子的电子式为
 (用相关的化学用语作答).
(用相关的化学用语作答).③Y的氢化物沸点<Z的氢化物的沸点(填“>”“<”或“=”).
④基态W原子的外围电子排布式为3d54s1.
⑤Q的氢化物的晶胞结构如图1所示,其化学式是CuH.
(2)过渡元素在生活、生产和科技等方面有广泛的用途.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
| 元素 | Mn | Fe |
| 电离能 | ||
| (kJ•mol-1) | ||
| I1 | 717 | 759 |
| I2 | 1 509 | 1561 |
| I3 | 3 248 | 2 957 |
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如3-图丙所示.晶胞中铂(Pt)原子的配位数数为为12.

13.下列事实能用化学平衡移动原理解释的是( )
| A. | 加热或光照时,浓HNO3更易发生分解 | |
| B. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
3.相同质量的下列各烃,完全燃烧后生成CO2最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |

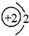 、O
、O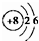 、Ca
、Ca .
.