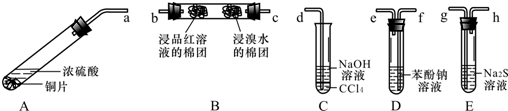
题目内容
9.将3.2g铜粉与过量硝酸(amol/L,30mL),充分反应,硝酸的还原产物为NO2和NO.反应后溶液中含H+为0.1mol,求:(1)此时溶液中所含NO3-的物质的量.(2)生成的NO2和NO的物质的量.(用含有a的数学式子表示)
分析 将3.2g即0.05mol铜粉与过量硝酸(amol/L,30mL),充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含H+为0.1mol,所以剩余硝酸是0.1mol,参加反应的硝酸表现氧化性和酸性,根据Cu元素守恒可以计算显示酸性的硝酸的量,做氧化剂的硝酸产物是NO2和NO,根据元素守恒和电子守恒来计算即可.
解答 解:(1)将3.2g即0.05mol铜粉与过量硝酸(amol/L,30mL),充分反应,根据Cu元素守恒,生成硝酸铜是0.05mol,显示酸性的硝酸的量0.1mol,硝酸根离子为0.1mol,反应后溶液中含H+为0.1mol,所以剩余硝酸是0.1mol,此部分硝酸根离子是0.1mol,所以此时溶液中所含NO3-的物质的量是0.1mol+0.1mol=0.2mol,
答:此时溶液中所含NO3-的物质的量是0.2mol;
(2)3.2g即0.05mol铜粉失去电子的物质的量:0.05mol(2-0)=0.1mol,反应后溶液中含H+为0.1mol,所以剩余硝酸是0.1mol,消耗的硝酸是(0.03a-0.1)mol,设生成的NO2和NO的物质的量分别是x、y,根据Cu元素守恒,生成硝酸铜是0.05mol,此部分硝酸根离子是0.1mol,剩余硝酸是0.1mol,根据N元素守恒:x+y+0.1=(0.03a-0.1)mol,根据电子守恒:0.1mol=x+3y,联立方程式,解得x=(0.045a-0.35)mol,y=0.015(10-a)mol,
答:生成的NO2和NO的物质的量分别是:(0.045a-0.35)mol,0.015(10-a)mol.
点评 本题考查学生氧化还原反应中电子守恒在计算中的应用知识,属于综合知识的考查题,难度不大.

练习册系列答案
相关题目
19. 某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | A═B的反应热△H=+(E2-E1)KJ/mol | B. | 三种化合物中C最稳定 | ||
| C. | C═B 是放热反应 | D. | 整个反应中△H=E1-E4 |
17.常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol•L-1NaOH溶液.整个实验过程中溶液的pH变化曲线如右图所示,不考虑次氯酸分解,下列叙述正确的是( )
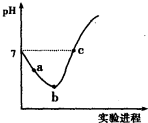

| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
4.下列各组物质之间不能通过一步就能实现a→b→c→d→a转化的是( )
| a | b | c | d | |
| A | Cu | CuSO4 | Cu(OH)2 | Cu2O |
| B | N2 | NO2 | HNO3 | NO |
| C | CH3OH | HCHO | HCOOH | HCOOCH3 |
| D | Na | Na2O2 | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
1.用NA表示伏伽德罗常数的值,下列说法错误的是( )
| A. | 常温常压下28g氮气含有的原子数是2NA | |
| B. | 标准状况下,22.4L醋酸的水分子数是NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 500mL 2mol•L-1Al(SO4)3溶液中SO42-的数目为3NA |
5.下列有关多电子原子的叙述中,正确的是( )
| A. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| B. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| C. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 | |
| D. | 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 |
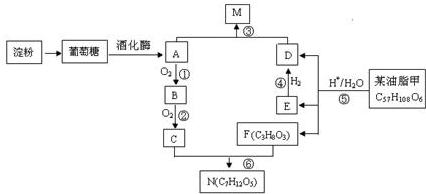
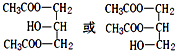 ;C与F按不同的比例,还可以生成另外两种物质X、Y,且相对分子量X<N<Y,则Y的分子式C9H14O6.
;C与F按不同的比例,还可以生成另外两种物质X、Y,且相对分子量X<N<Y,则Y的分子式C9H14O6. C17H35COOCH2CH3+H2O.
C17H35COOCH2CH3+H2O.