题目内容
4.某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如图所示(图中连接胶管、夹持和加热装置省略):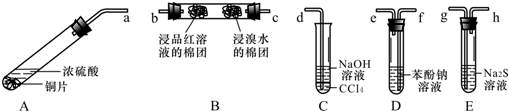
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近.请回答下列问题:
(1)装置A中发生反应的化学方程式是:ACu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)上述装置的接口连接顺序依次是a→f→e→c→b→g→h→d(填导管接口字母).
(3)证明SO2具有氧化性的现象是E试管中溶液变浑浊;证明SO2具有还原性的实验中,反应的离子方程式是SO2+Br2+2H2O=SO42-+2Br-+4H+.
(4)C试管中NaOH溶液的作用是吸收未反应完的SO2,以免污染空气,CCl4的作用是防止溶液倒吸.
分析 由实验目的可知,A为制备二氧化硫的发生装置,发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,D装置利用强酸制备弱酸原理检验其酸性氧化物的性质,B中溴水具有强氧化性,可以检验二氧化硫的还原性,二氧化硫与品红化合为无色物质,可以检验二氧化硫的漂白性,E中硫化钠与二氧化硫在酸性条件下生成硫,检验二氧化硫弱氧化性,由于二氧化硫可以污染大气,未反应的二氧化硫需要进行尾气处理,C装置中氢氧化钠可以吸收二氧化硫,导管深入四氯化碳中,可以防止倒吸.
解答 解:由实验目的可知,A为制备二氧化硫的发生装置,发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,D装置利用强酸制备弱酸原理检验其酸性氧化物的性质,B中溴水具有强氧化性,可以检验二氧化硫的还原性,二氧化硫与品红化合为无色物质,可以检验二氧化硫的漂白性,E中硫化钠与二氧化硫在酸性条件下生成硫,检验二氧化硫弱氧化性,由于二氧化硫可以污染大气,未反应的二氧化硫需要进行尾气处理,C装置中氢氧化钠可以吸收二氧化硫,导管深入四氯化碳中,可以防止倒吸,
(1)A中发生的反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)由上述分析可知,装置的接口连接顺序依次是a→f→e→c→b→g→h→d,
故答案为:f;e; c; b;
(3)E中硫化钠与二氧化硫在酸性条件下生成硫,检验二氧化硫弱氧化性,现象是:E试管中溶液变浑浊;
B中溴水具有强氧化性,可以检验二氧化硫的还原性,反应离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+,
故答案为:E试管中溶液变浑浊;SO2+Br2+2H2O=SO42-+2Br-+4H+;
(4)C试管中NaOH溶液的作用是:吸收未反应完的SO2,以免污染空气,CCl4的作用是:防止溶液倒吸,
故答案为:吸收未反应完的SO2,以免污染空气;防止溶液倒吸.
点评 本题考查二氧化硫的制备与性质探究实验,关键理解实验原理、明确各装置作用,侧重于学生的分析能力和实验能力的考查,难度不大.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案| A. |  利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. |  利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
| A. | BaSO3和BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO4 |
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低.课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是NH4+(化学式).
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是ab.
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响.
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等.
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定相同条件下硝酸根离子浓度的变化量(要求所测得的数据能直接体现反应速率大小).
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示).
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
| 物理量 实验序号 | V(2.0mol/L KNO3)/ mL | … | |
| 1 | a | … | |
| 2 | a | … | |
| 3 | a | … |
