题目内容
【题目】近日,由浙江大学饶灿教授课题组发现的一种新矿物LiAl5O8,被国际矿物学协会命名为“竺可桢石”,英文名为Chukochenite。回答下列问题:

(1)基态Li+核外电子的电子云轮廓图为___________。
(2)第二电离能:I2(Mg)___________I2(Al)(填“>”“<”或“=”)。
(3)已知:O2-、F-的半径依次为140 pm、136 pm,Li2O、LiF的熔点依次为1840K、1121K。Li2O的熔点高于LiF的主要原因是____________。
(4)LiAlH4是重要供氢剂和还原剂,工业上利用AlC3和LiH在特殊条件下合成LiAlH4。
①氯化铝蒸气中存在Al2Cl6分子且每个原子价层都达到8电子结构,画出Al2Cl6的结构式___________。(要注明配位键和普通共价键),铝的杂化类型是___________。
②AlH![]() 的空间结构是_____________。
的空间结构是_____________。
(5)某锂钴复合氧化物晶胞如图1所示。该化合物的化学式为_______________。Co3+和NH3形成配离子[Co(NH3)6]3+,游离态NH3中键角∠HNH___________(填“大于”“小于”或“等于”)[Co(NH3)6]3+中键角∠HNH。
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属于正交晶系(长方体形)。品胞参数为0.75 nm、1.0 nm、0.56 nm。如图2为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
①据此推断该晶胞中氯原子数目为___________。LiCl·3H2O的摩尔质量为M g·mol-1,晶胞密度为d g·cm-3,则阿伏加德罗常数NA为___________mol-1(列出计算表达式)。
②图2中A、B两原子核间距离为___________nm(只列计算式)。
【答案】球形 < O2-的电荷数是F-的2倍 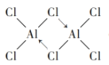 sp3 正四面体 LiCoO2 小于 4
sp3 正四面体 LiCoO2 小于 4 ![]()
![]()
【解析】
根据原子失去一个电子之后的电子排布分析第二电离能的大小;根据阴离子半径和电荷数判断离子晶体的熔沸点高低;根据价层电子对互斥理论判断离子的空间构型;根据均摊法计算晶胞中各原子的个数,通过晶胞体积和晶胞质量计算阿伏伽德罗常数。
(1)基态Li+的电子排布式为1s2,电子云呈球形;
(2) Al+、Mg+的电子排布式分别为3s2、3s1,全充满结构比半充满稳定,铝的核电荷数多,故镁的第二电离能小于铝;
(3)氧化锂、氟化锂都是离子晶体,阴离子半径相差较小,氧化锂中氧离子所带电荷数是氟离子二倍,故氧化锂中离子键比氟化锂强,氧化锂熔点高于氟化锂;
(4)①Al2Cl6分子中存在2个配位键,结构简式如图所示 ,其中Al形成4个单键,采用sp3杂化;
,其中Al形成4个单键,采用sp3杂化;
②![]() 中铝原子价层有4个电子对,空间结构为正四面体;
中铝原子价层有4个电子对,空间结构为正四面体;
(5)观察图1可知,Li原子数为![]() =9,Co原子数为
=9,Co原子数为![]() =9,O原子数为
=9,O原子数为![]() =18,故该化合物中Li、Co、O个数之比为1∶1∶2,该化合物的化学式为LiCoO2;[Co(NH3)6]3+中NH3的N原子价层孤电子对与钴离子形成配位键,孤电子对对成键电子对排斥力减小,故键角较大;
=18,故该化合物中Li、Co、O个数之比为1∶1∶2,该化合物的化学式为LiCoO2;[Co(NH3)6]3+中NH3的N原子价层孤电子对与钴离子形成配位键,孤电子对对成键电子对排斥力减小,故键角较大;
(6)①观察图2知,yz面上有4个氯原子,体内有2个氯原子,所以1个该品胞含4个氯原子。1cm =107nm,由密度公式知,NA=![]() mol-1;
mol-1;
②观察A、B原子坐标参数,它们在x轴参数都是0.5,相当于A、B原子在yz面上。可以建立直角三角形,AB距离是这个三角形的斜边。根据三角形勾股定理可知,AB=![]() nm。
nm。

 阅读快车系列答案
阅读快车系列答案【题目】丙烯(C2H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
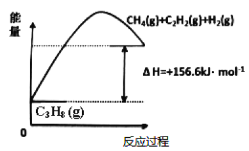
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是________。
②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol,通入O2的目的是_______。
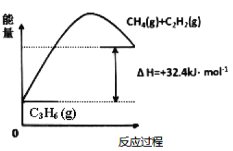
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8(g)+C2H4(g)2C3H6(g) H>0
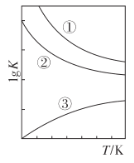
①某温度下,上述反应中,正反应速率为v正=K正c(C4H8)c(C2H4)、逆反应速率为v逆=K逆c2(C3H6),其中K正、K逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是_____________
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使K正和K逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应程度无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___________25%(填“>”、“<”、“=”)。
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
Ⅰ. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
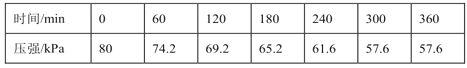
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应Ⅰ,容器内气体的压强随时间的变化如表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。