题目内容
【题目】丙烯(C2H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
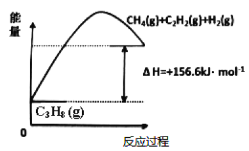
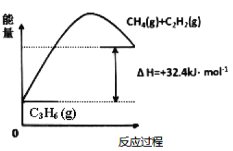
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是________。
②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol,通入O2的目的是_______。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8(g)+C2H4(g)2C3H6(g) H>0
①某温度下,上述反应中,正反应速率为v正=K正c(C4H8)c(C2H4)、逆反应速率为v逆=K逆c2(C3H6),其中K正、K逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是_____________
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使K正和K逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应程度无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___________25%(填“>”、“<”、“=”)。
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
Ⅰ. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应Ⅰ,容器内气体的压强随时间的变化如表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
【答案】+124.2 升高温度 丙烷直接裂解是吸热反应,通入足量O2可提供裂解所需的能量,并保持热平衡 BCD > 0.09 0.21
【解析】
I.(1)结合图像及盖斯定律进行计算;
①反应为吸热反应,升高温度,反应速率增大和平衡正向移动;
②通入足量O2可与裂解产生的氢气反应,提供裂解所需的能量,并保持热平衡;
(2)①A.催化剂参与了歧化反应,生成了中间产物,即改变反应历程;
B.催化剂导致反应速率增大,但化学平衡常数不变,则使K正和K逆增大相同的倍数;
C.催化剂导致反应速率增大,则降低了烯烃歧化反应的活化能,增大了活化分子百分数;
D.根据公式,速率常数的大小与反应的始态或终态有关,与反应程度无关系;
②Qc与K的关系判断;
II.利用三段式及反应速率的公式进行计算。
(1)根据左图,可得①C3H8(g)C2H2(g)+H2(g)+CH4(g) H=+156.6kJ/mol,右图可得,②C3H6(g) C2H2(g)+CH4(g) H=+32.4kJ/mol,根据盖斯定律,①-②可得C3H8(g)C3H6(g)+H2(g),则H=+124.2kJ/mol;
①该反应为吸热反应,升高温度,可同时提高反应速率和反应物的平衡转化率;
②丙烷直接裂解是吸热反应,通入足量O2可与裂解产生的氢气反应,提供裂解所需的能量,并保持热平衡;
(2)①A.催化剂参与了歧化反应,生成了中间产物,即改变反应历程,说法错误,A错误;
B.催化剂导致反应速率增大,但化学平衡常数不变,则使K正和K逆增大相同的倍数,说法正确,B正确;
C.催化剂导致反应速率增大,且不影响反应的焓变,则降低了烯烃歧化反应的活化能,增大了活化分子百分数,说法正确,C正确;
D.根据公式,速率常数的大小与反应的始态或终态有关,与反应程度无关系,说法正确,D正确;
答案为BCD;
②已知平衡时,n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%,![]() =25%,则b=amol,K=0.5;再往容器内通入等物质的量的C4H8和C2H4,化学平衡常数不变,则Qc=
=25%,则b=amol,K=0.5;再往容器内通入等物质的量的C4H8和C2H4,化学平衡常数不变,则Qc=![]() (x>0),(1+x)(2+x)>2,Qc<K,则平衡正向移动,再次达到平衡时C3H6的体积分数大于25%;
(x>0),(1+x)(2+x)>2,Qc<K,则平衡正向移动,再次达到平衡时C3H6的体积分数大于25%;
II.①前120min内压强减小即P=80-69.2=10.8kPa,则v(CH2ClCHClCH3)=![]() =0.09kPamin-1。
=0.09kPamin-1。
②
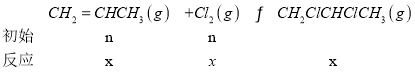
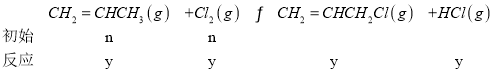
根据表格数据可知,300min达到平衡,则![]() =
=![]() ,x=0.56n;平衡时HCl的体积分数为12.5%,即
,x=0.56n;平衡时HCl的体积分数为12.5%,即![]() =12.5%,则y=0.18n,Kp=
=12.5%,则y=0.18n,Kp=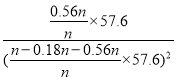 =0.21kPamin-1。
=0.21kPamin-1。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
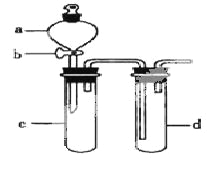
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是_________;该小组同学实验目的是_________,但此实验的不足之处是_____________________。