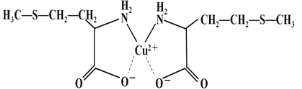
题目内容
【题目】丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯乙烯、异丙烯等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)![]() C3H6(g)+H2(g) ΔH=___kJ/mol。
C3H6(g)+H2(g) ΔH=___kJ/mol。

①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___。
②目前在丙烷脱氢制丙烯时常加入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8+C2H4![]() 2C3H6(g) ΔH>0。
2C3H6(g) ΔH>0。
①某温度下,上述反应中,正反应速率为v正=k正c(C4H8)c(C2H4)、逆反应速率为v逆=k逆c2(C3H6),其中k正、k逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是___。
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使k正和k逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应历程无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___25%。(填“>”、“<”、“=”)
(3)工业上可用丙烯加成法制备1,2—二氯丙烷(CH2ClCHClCH3),主要副产物为3—氯乙烯(CH2=CHCH2Cl),反应原理为
Ⅰ.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g)
CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
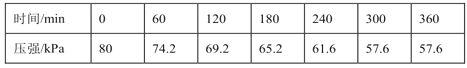
①用单位时间内气体分压的变化来表示反应速率,即v=![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__kPa-1。(Kp为以分压表示的平衡常数,保留小数点后2位。)
【答案】+124.2 升高温度 丙烷直接裂解是吸热反应,通入足量O2可提供裂解所需的能量,并保持热平衡 BCD > 0.09 0.21
【解析】
(1)据图可知i:C3H8(g)=CH4(g)+C2H2(g)+H2(g)△H1=156.6kJmol-1
ii:C3H6(g)=CH4(g)+C2H2(g)△H2=32.4kJmol-1
根据盖斯定律由i-ii可得C3H8(g)C3H6(g)+H2(g)的△H=+124.2kJ/mol;
①该反应焓变大于0,为吸热反应,所以升高温度既可以提高反应速率也可以提高反应物的平衡转化率;而催化剂虽然能增大反应速率,但不改变平衡转化率,加压可以提高反应速率,但平衡逆向移动,转化率减小;加入一定量的C3H8也可以提高反应速率,但同时也会增大压强,反应物的转化率会减小,综上所述可行的方法为升高温度;
②丙烷直接裂解是吸热反应,通入足量O2与丙烷反应会放出热量,可提供裂解所需的能量,并保持热平衡;
(2)①A.催化剂会改变反应历程,从而降低反应的活化能,提高反应速率,故A错误;
B.催化剂可以加快反应速率,但不影响平衡状态,即催化剂对正逆反应速率的影响是一致的,故B正确;
C.催化剂可以降低反应的活化能,从而使能量较低的分子也成为活化分子,增大了活化分子的百分数,故C正确;
D.反应平衡时,v正=k正c(C4H8)c(C2H4)=v逆=k逆c2(C3H6),所以![]() ,而平衡常数的大小与温度有关,所以速率常数的大小与温度有关,与反应历程无关,故D正确;
,而平衡常数的大小与温度有关,所以速率常数的大小与温度有关,与反应历程无关,故D正确;
综上所述选BCD;
②平衡时C3H6的体积分数为25%,则容器内气体总物质的量为4b mol,所以有(a+2a+b)mol=4b mol,所以a=b;根据反应方程式可知,初始投料为n(C4H8)=1.5a mol,n(C2H4)=2.5amol,n(C4H8):n(C4H8)<1:1,对于可逆反应,同一温度下,当投料比与计量数之比相等时生成物的体积分数最大,再往容器内通入等物质的量的C4H8和C2H4,使初始投料比更接近1:1,产物的体积分数增大,所以新平衡中C3H6的体积分数大于25%。
(3)①反应Ⅱ前后气体系数之和相同,反应I为气体减少的反应,所以压强的减小是由反应I引起的,且根据系数变化可知△p(CH2ClCHClCH3)与容器压强的变化相同,所以12min内△p(CH2ClCHClCH3)=(80-69.2)kPa=10.8kPa,则v(CH2ClCHClCH3)=![]() = 0.09 kPamin-1;
= 0.09 kPamin-1;
②恒容密闭容器中气体的压强之比等于物质的量之比,等于体积之比;初始压强为80kPa,则不妨设初始投料为CH2=CHCH3(g)和Cl2(g)各40mol,根据表格数据可知平衡时压强为57.6kPa,则气体的总物质的量为57.6mol;△n总=(80-57.6)mol=22.4mol,则反应I中生成的n(CH2ClCHClCH3)=22.4mol,消耗的nI(CH2=CHCH3)= nI(Cl2)=22.4mol;HCl的体积分数为12.5%,则n(HCl)=57.6mol×12.5%=7.2mol,根据反应II的方程式可知消耗的nII(CH2=CHCH3)= nII(Cl2)=7.2mol,所以平衡时n(CH2=CHCH3)= n(Cl2)=(40-22.4-7.2)mol=10.4mol;综上所述平衡时n(CH2ClCHClCH3)=22.4mol,n(CH2=CHCH3)= n(Cl2)=10.4mol,则p(CH2ClCHClCH3)=22.4kPa,p(CH2=CHCH3)= p(Cl2)=10.4kPa,所以Kp=![]() =0.21kPa-1。
=0.21kPa-1。

【题目】
废旧可充电电池主要含有Fe、Ni、Cd、Co等金属元素,一种混合处理各种电池回收金属的新工艺如下图所示。
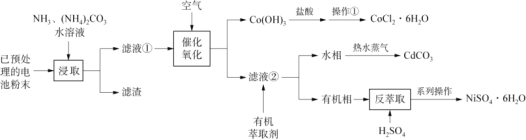
已知:Ⅰ.滤液①中含有Ni(NH3)62+、Cd(NH3)42+、Co(NH3) 62+等物质。
Ⅱ.萃取和反萃取的反应原理分别为:
Ni(NH3)62++ 2HR![]() NiR2+2NH4++4NH3 ;NiR2+2H+
NiR2+2NH4++4NH3 ;NiR2+2H+![]() Ni2+ +2HR
Ni2+ +2HR
(1)为了加快浸取速率,可采取的措施为__________(任写一条)。
(2)已知浸取过程中NH3和NH4+的物质的量之和与Ni、Cd、Co浸取率的关系如表2所示。
表2 浸取过程中氨总量与各离子浸取率的关系
编号 | n(NH3)+ n(NH4+)/mol | Ni浸取率/% | Cd浸取率/% | Co浸取率/% |
① | 2.6 | 97.2 | 88.6 | 98.1 |
② | 3.5 | 86.0 | 98.8 | 86.7 |
③ | 4.8 | 98.4 | 98.8 | 94.9 |
④ | 5.6 | 97.7 | 85.1 | 96.8 |
⑤ | 9.8 | 95.6 | 84.1 | 96.1 |
则可采用的最佳实验条件编号为_____。
(3)Co(OH)3与盐酸反应产生气体单质,该反应的化学方程式______。
(4)操作①的名称为_________、过滤、洗涤。
(5)向有机相中加入H2SO4能进行反萃取的原因为_______(结合平衡移动原理解释)。
(6)将水相加热并通入热水蒸气会生成CdCO3沉淀,并产生使红色石蕊试纸变蓝的气体,该反应的离子方程式为___。
(7)上述工艺流程中可能循环使用的物质为______。
(8)已知Ksp(CdCO3)=1.0×10-12,Ksp(NiCO3)=1.4×10-7。若向物质的量浓度均为0.2mol/L的Cd2+和Ni2+溶液中滴加Na2CO3溶液(设溶液体积增加1倍),使Cd2+恰好沉淀完全,即溶液中c(Cd2+)=1.0×10-5mol/L时,是否有NiCO3沉淀生成(填“是”或者“否”)____。