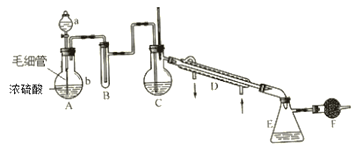
题目内容
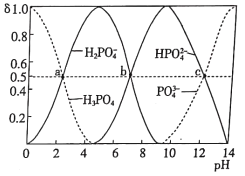
【题目】如图为室温时不同pH下磷酸钠盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、12.66,其中δ表示含磷微粒的物质的量分数。下列说法正确的是
A.选择酚酞作指示剂,用NaOH溶液滴加磷酸溶液的反应为H3PO4+3OH-=PO![]() +3H2O
+3H2O
B.室温下,水电离的c(H+)·c(OH-):a<b<c
C.a、b、c点对应水溶液中c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )之和相等
)之和相等
D.室温下,H3PO4的第三级电离常数的数量级为10-12
【答案】B
【解析】
A.用NaOH溶液滴加磷酸溶液时,当发生反应HPO42-+OH-=PO43-+H2O时,δ(HPO42-)减小,δ(PO43-)增大,酚酞的变色范围为8-10,在此pH变化范围内,无法用酚酞指示终点,故A错误;
B.溶液中的H+抑制水的电离,当H+降低时,水的电离程度增大,且溶液中的HPO42-、PO43-水解促进水的电离,且随HPO42-、PO43-浓度增大,水的电离程度增大,则水电离的c(H+)·c(OH-):a<b<c,故B正确;
C.根据物料守恒,在a、b、c点[c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )] ×V始终是相等的,但随溶液pH的增大,溶液的体积增大,则c(H3PO4)+c(H2PO
)] ×V始终是相等的,但随溶液pH的增大,溶液的体积增大,则c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )之和逐渐减小,故C错误;
)之和逐渐减小,故C错误;
D.当pH=12.66时,c(HPO42-)=c(PO43-),H3PO4的第三级电离为HPO42- ![]() H++PO43-,三级电离平衡常数Ka3=
H++PO43-,三级电离平衡常数Ka3=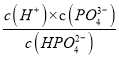 =10-12.66=100.34×10-13,其数量级为10-13,故D错误;
=10-12.66=100.34×10-13,其数量级为10-13,故D错误;
故答案为B。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目