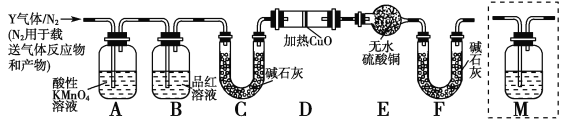
题目内容
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G 的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图________________。
(2)A和D可形成化合物的化学式为______________。
(3)B元素在周期表中的位置为________________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为__________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)______________________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为__________________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为__________,能够用于漂白的固体物质中阴、阳离子个数比为____________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:________________________。
【答案】![]() H2O、H2O2 第二周期第ⅣA族 CO2+OH-=HCO3- S2-、O2-、Na+、Al3+ 2Al+2OH-+2H2O=2AlO
H2O、H2O2 第二周期第ⅣA族 CO2+OH-=HCO3- S2-、O2-、Na+、Al3+ 2Al+2OH-+2H2O=2AlO![]() +3H2↑ 共价键 1∶2 HS-+OH-=S2-+H2O或H2S+OH-=HS-+H2O或H2S+2OH-=S2-+2H2O
+3H2↑ 共价键 1∶2 HS-+OH-=S2-+H2O或H2S+OH-=HS-+H2O或H2S+2OH-=S2-+2H2O
【解析】
根据题干信息中元素的性质、核外电子排布情况及在元素周期表中的位置分析判断各元素的种类;根据元素周期律及微粒结构、成键方式分析解答。
B元素一种原子的含量常用于判定古生物遗体的年代,B为碳元素;A和C元素的原子能形成4核10电子的微粒,A为氢元素,C为氮元素;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30,所以各离子核外电子总数为10,所以E为Na元素、D为O元素;G和D同主族,G为硫元素;E、F、G的最高价氧化物对应的水化物之间可以相互反应,F为铝元素;综上分析可知:A为H元素、B为C元素、C为N元素、D为O元素、E为Na元素、F为Al元素、G为S元素;
(1)C为氮元素,原子结构示意图![]() ,故答案为:
,故答案为:![]() ;
;
(2)A和D可形成化合物水和过氧化氢,化学式为H2O和H2O2,故答案为:H2O和H2O2;
(3)C核电荷数为6,在周期表中的位置为第二周期第ⅣA族;过量的CO2与NaOH溶液反应生成NaHCO3,离子方程式为CO2+OH-=HCO3-,故答案为:第二周期第ⅣA族;CO2+OH-=HCO3-;
(4)D为O元素、E为Na元素、F为Al元素、G为S元素;离子的电子层数越多,则离子半径越大,电子层相同时,离子的核电荷数越大,则离子半径越小,则四种元素对应的离子半径大小为:S2-、O2-、Na+、Al3+;
(5)金属铝与钠元素的最高价氧化物对应的水化物氢氧化钠反应生成偏铝酸钠和氢气,离子方程式为:2Al+2OH-+2H2O=2AlO+3H2↑;
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质为二氧化硫,含有的化学键类型为共价键;具有漂白作用的离子化合物为过氧化钠,属于离子化合物,阴、阳离子个数比为1∶2;
(7)D为O元素,O与H形成的10电子微粒为OH-(X),G元素为S,硫原子与氢原子形成的18电子微粒HS-或H2S(Y),二者发生反应生成盐和水,离子方程式:HS-+OH-=S2-+H2O或H2S+OH-=HS-+H2O或H2S+2OH-=S2-+2H2O。

【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | I3—溶液中存在平衡: I3— |
B | 在Ca(ClO)2溶液中通入SO2气体,有沉淀生成 | 酸性:H2SO3>HClO |
C | 向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去 | 氯气具有强氧化性和漂白性 |
D | 在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色 | 植物油含有酯基 |
A.AB.BC.CD.D