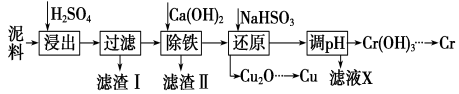
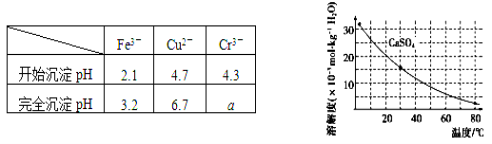
题目内容
【题目】(16分)汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)2CO2(g)+N2(g)△H=﹣746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)2CO(g)△H=﹣221.0KJ/mol
C (s)+O2(g)CO2(g)△H=﹣393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJmol﹣1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 | |||||||
C(NO)10﹣4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 | |||||||
C(CO)10﹣3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 | |||||||
则C2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比![]() 的变化曲线如图1所示。
的变化曲线如图1所示。
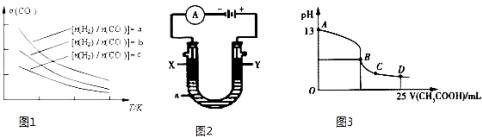
①a、b、c按从大到小的顺序排序为 。
②根据图象可以判断该反应为放热反应,理由是 。
(5)CO分析的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2﹣。
①则负极的电极反应式为 。
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL 上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中 消耗一氧化碳的质量为 g。
【答案】(1)+180.5 kJmol﹣1; (2)D; (3)0.6; =;(4)① a>b>c;
②投料比相同,温度越高CO的转化率越低,平衡向左移动,推得该反应为放热反应;
(5)① CO+2O2﹣﹣2e﹣=CO32﹣; ②2.8g
【解析】
试题分析:(1)已知热化学方程式①2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.5KJ/mol
2CO2(g)+N2(g)△H=-746.5KJ/mol
②2C(s)+O2(g)![]() 2CO(g)△H=-221.0KJ/mol
2CO(g)△H=-221.0KJ/mol
③C(s)+O2(g)![]() CO2(g)△H=-393.5KJ/mol
CO2(g)△H=-393.5KJ/mol
根据盖斯定律可知③×2-①-②即得到反应N2(g)+O2(g)=2NO(g)的反应热△H=(746.5+221.0-393.5×2)kJ·mol-1=+180.5kJ·mol-1。
(2)由题中所给数据可知第1s~3s c(NO)减小3×10-4 mol/L,则1s~2s的变化量必介于1.5×10-4 mol/L~3×10-4 mol/L之间,答案选D。
(3)①根据实验i组的数据,CO的起始量为4mol,平衡量为2.4mol,反应消耗掉1.6mol,根据化学方程式可知,CO2的生成量为1.6mol,所以v(CO2)表示的反应速率为1.6mol÷(2L×5min)=0.16mol·L-1·min-1 ;
②根据第②组数据可得关系式为
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol)1 2 0 0
平衡量(mol)0.6 1.6 0.4 0.4
在900℃时的K=(0.2×0.2)÷(0.8×0.3)=1/6
如果温度仍然是900℃,则
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 2 1 0 0
平衡量(mol)2-x 1-x x x
即x2÷[(2-x)(1-x)]=1/6
解得x=0.4,则c=0.6mol。
α2(H2O)=40%,α3(CO)=40%,所以α2(H2O)=α3(CO)。
(4)①在其他条件不变时,增大氢气的浓度可以提高CO转化率,则根据图像可知a、b、c按从大到小的顺序排序为a>b>c。
②根据图像可知在比值不变时,升高温度CO转化率降低,这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应。
(5)①在原电池中,负极失去电子发生氧化反应,而CO在负极通入,所以负极的电极反应式为CO+2O2﹣﹣2e﹣=CO32﹣。
②惰性电极电解氯化钾溶液的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。根据图像可知氢氧化钾溶液的浓度是0.1mol/L,则反应中生成氢氧化钾是0.2mol,转移0.2mol电子,所以根据电子得失守恒可知消耗CO是0.1mol,则CO的质量是2.8g。
Cl2↑+H2↑+2OH-。根据图像可知氢氧化钾溶液的浓度是0.1mol/L,则反应中生成氢氧化钾是0.2mol,转移0.2mol电子,所以根据电子得失守恒可知消耗CO是0.1mol,则CO的质量是2.8g。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案