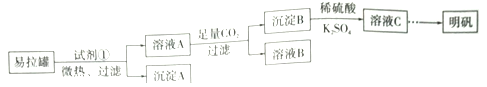
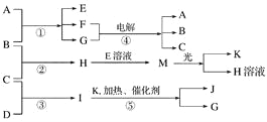
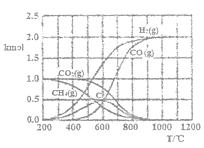
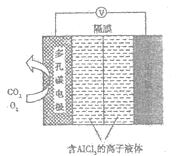
题目内容
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向偏铝酸钠溶液中通入过量的CO2:2AlO![]() +CO2+3H2O=2Al(OH)3↓+CO
+CO2+3H2O=2Al(OH)3↓+CO![]()
B.向HNO2溶液中滴加酸性KMnO4溶液:5NO![]() +2MnO
+2MnO![]() +3H2O=5NO
+3H2O=5NO![]() +2Mn2++3OH-
+2Mn2++3OH-
C.向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH![]() +H++SO
+H++SO![]() =BaSO4↓+NH3H2O+H2O
=BaSO4↓+NH3H2O+H2O
D.向银氨溶液中滴加乙醛溶液并水浴加热:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH
CH3COO-+NH![]() +2Ag↓+H2O+3NH3
+2Ag↓+H2O+3NH3
【答案】D
【解析】
A. 向偏铝酸钠溶液中通入过量的CO2生成碳酸氢钠和氢氧化铝:AlO![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO![]() ,A错误;
,A错误;
B. 亚硝酸是弱电解质,向HNO2溶液中滴加酸性KMnO4溶液:5HNO2+2MnO![]() +H+=5NO
+H+=5NO![]() +2Mn2++3H2O,B错误;
+2Mn2++3H2O,B错误;
C. 向NH4HSO4溶液中滴加少量的Ba(OH)2溶液铵根不反应:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O,C错误;
=BaSO4↓+2H2O,C错误;
D. 向银氨溶液中滴加乙醛溶液并水浴加热发生银镜反应:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH
CH3COO-+NH![]() +2Ag↓+H2O+3NH3,D正确;
+2Ag↓+H2O+3NH3,D正确;
答案选D。

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目