题目内容
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
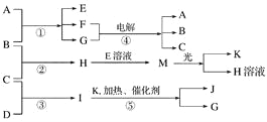
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
【答案】Cl2 NH3 NO NaOH H++ClO-=HClO NH3+H2O![]() NH3·H2O 2NaOH+Cl2=NaCl+NaClO+H2O
NH3·H2O 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
a、I、e是三种由短周期元素构成的粒子,它们都有10个电子,a单核带一个单位的正电荷,应为Na+;I为四核分子,则I为NH3,e为双核带一个单位负电荷的阴离子,则I为OH-;物质A由a、e构成,则A为NaOH,根据④电解生成A(NaOH),可考虑到氯碱工业,再结合反应①,可知B:Cl2;C:H2;H:HCl;又因H可以与E反应生成M,M光照分解生成氯化氢和K,则推知E:NaClO;F:NaCl;G:H2O;M:HClO;K:O2;再结合⑤即氨的催化氧化,可知D:N2;I:NH3;J:NO。据此解答。
根据以上分析可知A为NaOH,B为Cl2,C为H2,D为N2,E为NaClO,F为NaCl,G为H2O,H为HCl,I为NH3,J为NO,K为O2,M为HClO,则
(1)由上述分析可以知道: B为Cl2,I为NH3,J为NO;
(2)因为物质A由a、e构成,a是Na+、e是OH-,则A为NaOH,故A的化学式是NaOH;
(3)①由上述分析知,H是HCl、E是NaClO、M是HClO,所以H+E(溶液)→M的离子方程式为:H++ClO-=HClO;
②由上述分析知,I是NH3、G是H2O,故I溶于G的离子方程式为:NH3+H2O![]() NH3·H2O;
NH3·H2O;
(4)由分析知反应①的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。

【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生