��Ŀ����
����Ŀ��I.NO��һ�ֳ����������������о�������Ҫ�ļ�ֵ�����塣
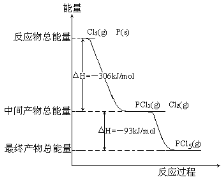
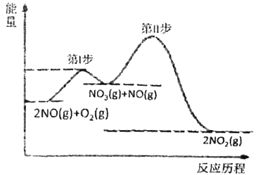
��1��2NO(g)+O2(g)=2NO2(g) ��H=akJ/mol�ķ�Ӧ�����������仯��ϵ��ͼ��ʾ��
��a___0(���)
����֪���ڢ�ӦΪ��NO3(g)+NO(g)=2NO2(g) ��H=bkJ/mol
��I����Ӧ���Ȼ�ѧ����ʽΪ___��
��2������β���г�����NO��NH3�ڼ��Ⱥʹ������ڵ�������������NO����Ⱦ��
��֪��4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905kJ/mol
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=��1268kJ/mol
NH3��NO��Ӧ���Ȼ�ѧ����ʽΪ___��
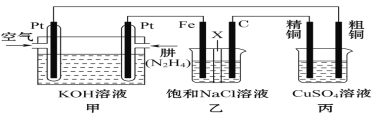
��3����ҵ��NO����Ҫ��Դ��NH3��NH3Ҳ����Ϊȼ����Ƴɼ���ȼ�ϵ�أ��ڼ��������£�ȼ�ϵ�ز�����ҪΪN2��ȼ�ϵ�ظ����ĵ缫��ӦʽΪ___��������Ϊȼ�ϵĵ�غͺ�̼��������Ϊȼ�ϵĵ����ȣ���Ҫ���ŵ���___��
II.�������ƺͶ��ȷ�![]() �ķ�ˮ��ͨ������װ�ô�������ԭ����ͼ��ʾ��
�ķ�ˮ��ͨ������װ�ô�������ԭ����ͼ��ʾ��
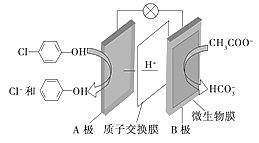
��1��д��HCO3-�ĵ���ʽ___���������к��еĻ�ѧ��������___��
��2����ص�������___����Һ��H+���ƶ�������___(��A��B��B��A)
��3��B�������ĵ缫��Ӧ����ʽΪ___��
���𰸡�< O2(g)+NO(g)=NO3(g) ��H=(a-b)kJ/mol 6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ��H=-1812.5kJ/mol 2NH3-6e-+6OH-=N2+6H2O �����ͷ���������CO2  ���Ӽ������ۼ� A B��A CH3COO--8e-+4H2O=2HCO3-+9H+
���Ӽ������ۼ� A B��A CH3COO--8e-+4H2O=2HCO3-+9H+
��������
I��(1)�ٷ�Ӧ������������������������������ӦΪ���ȷ�Ӧ��
���ܷ�ӦΪ��2NO(g)+O2(g)�T2NO2(g)��H=akJmol-1���ڢ�Ӧ��NO3(g)+NO(g)�T2NO2(g)��H=bkJmol-1�����ݸ�˹���ɣ��ڢ�Ӧ=�ܷ�Ӧ-�ڢ�Ӧ�õ��ڢ�Ӧ���Ȼ�ѧ����ʽ��
(2)��֪����4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905kJ/mol����4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=��1268kJ/mol�����ݸ�˹���ɿ�֪��![]() -��
-��![]() ���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) �����ɴ˼�����H���ɣ�
���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) �����ɴ˼�����H���ɣ�
(3)NH3Ϊȼ�ϵļ���ȼ�ϵ�أ�������ҪΪN2����ظ�������������Ӧ����̼��������Ϊȼ�ϵĵ�أ�����ΪCO2���壬���������ЧӦ��
II��A����![]() �õ��ӷ�����ԭ��Ӧ����
�õ��ӷ�����ԭ��Ӧ����![]() -OH��˵��AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������B�ǵ�صĸ�����
-OH��˵��AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������B�ǵ�صĸ�����
I��(1)����ͼʾ��֪2NO(g)+O2(g)=2NO2(g)�ķ�Ӧ�����������������������������Ӧ���ȣ��� a��0��
���ܷ�ӦΪ��2NO(g)+O2(g)�T2NO2(g)��H=akJmol-1���ڢ�Ӧ��NO3(g)+NO(g)�T2NO2(g)��H=bkJmol-1���ɸ�˹�����У��ڢ�Ӧ=�ܷ�Ӧ-�ڢ�Ӧ�õ��ڢ�Ӧ���Ȼ�ѧ����ʽO2(g)+NO(g)=NO3(g)��H=(a-b)kJmol-1��
(2)��֪����4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=��905kJ/mol����4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=��1268kJ/mol�����ݸ�˹���ɿ�֪��![]() -��
-��![]() ���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ������H=(��1268kJ/mol)
���ɵ�6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ������H=(��1268kJ/mol)![]() -(��905kJ/mol)
-(��905kJ/mol)![]() =-1812.5kJ/mol����NH3��NO��Ӧ���Ȼ�ѧ����ʽΪ6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ��H=-1812.5kJ/mol��
=-1812.5kJ/mol����NH3��NO��Ӧ���Ȼ�ѧ����ʽΪ6NO(g)+4NH3(g)=5N2(8)+6H2O(g) ��H=-1812.5kJ/mol��
(3)NH3Ϊȼ�ϵļ���ȼ�ϵ�أ�������ҪΪN2����ظ���ΪNH3����������Ӧ���缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O����̼��������Ϊȼ�ϵĵ�أ�����ΪCO2���壬������Ϊȼ�ϵĵ�ؿɼ�С��������CO2�ͷţ�
II��(1)HCO3-�ĵ���ʽΪ �����������Σ������ͻ�������еĻ�ѧ�����������Ӽ������ۼ���
�����������Σ������ͻ�������еĻ�ѧ�����������Ӽ������ۼ���
(2)A����![]() �õ��ӷ�����ԭ��Ӧ����
�õ��ӷ�����ԭ��Ӧ����![]() -OH����AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������Һ��H+���ƶ�������B��A��
-OH����AΪ��������ԭ����������ӵ��ƶ������ǴӸ�����������������Һ��H+���ƶ�������B��A��
(3)B��Ϊ������CH3COO-����������Ӧ����HCO3-���缫��Ӧ����ʽΪCH3COO--8e-+4H2O=2HCO3-+9H+��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����I����֪��448��ʱ����ӦH2(g)��I2(g)![]() 2HI(g)��ƽ�ⳣ��K1Ϊ49������¶��·�Ӧ
2HI(g)��ƽ�ⳣ��K1Ϊ49������¶��·�Ӧ![]() H2(g)��
H2(g)��![]() I2(g)
I2(g)![]() HI(g)��ƽ�ⳣ��K2Ϊ____________��
HI(g)��ƽ�ⳣ��K2Ϊ____________��
��II����һ��������ܱ������н������»�ѧ��Ӧ��CO2(g)��H2(g)![]() CO(g)��H2O(g)���仯ѧƽ�ⳣ��(K)���¶�(t)�Ĺ�ϵ�����ʾ��
CO(g)��H2O(g)���仯ѧƽ�ⳣ��(K)���¶�(t)�Ĺ�ϵ�����ʾ��
t/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��________��
��2���÷�ӦΪ________(����ȡ����ȡ�)��Ӧ��
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________��
A.������ѹǿ���� B.���������c(CO)����
C.v��(H2)��v��(H2O) D.c(CO2)��c(CO)
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c(CO2)��c(H2)��c(CO)��c(H2O)�����жϴ�ʱ���¶�Ϊ________�档
��5����800��ʱ������������Ӧ��ijʱ�̲�������ڸ����ʵ�Ũ�ȷֱ�Ϊc(CO2)Ϊ2mol��L��1��c(H2)Ϊ1.5mol��L��1��c(CO)Ϊ1mol��L��1��c(H2O)Ϊ3mol��L��1������һʱ�̣���Ӧ��________(���������)���С�