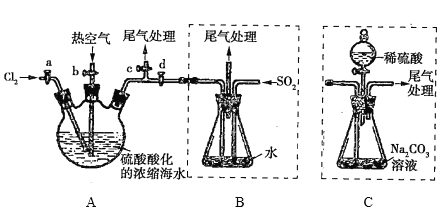
题目内容
【题目】常温下,向10mL ![]() 草酸
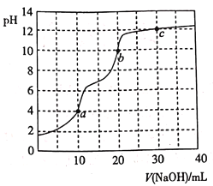
草酸![]() 溶液中逐滴加入等浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
溶液中逐滴加入等浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )

A.在溶液中水解程度大于电离程度
B.当V(NaOH) = 10 mL时溶液中存在:![]()
C.当V(NaOH) = 15 mL时,溶液中存在:![]()
D.当V(NaOH) = 20 mL时,溶液中存在:![]()
【答案】B
【解析】
A. 根据图示信息得到![]() 在溶液中存在时的
在溶液中存在时的![]() ,所以
,所以![]() 在溶液中水解程度小于电离程度,故A错误;
在溶液中水解程度小于电离程度,故A错误;
B. 当V(NaOH) = 10 mL时,溶液体积是原来的2倍,则溶液中物质浓度是原来的一半,任何电解质溶液中都存在物料守恒,根据物料守恒得![]() ,故B正确;
,故B正确;
C. 当V(NaOH) = 15 mL时,溶质为等浓度的![]() 和
和![]() ,溶液呈酸性,则
,溶液呈酸性,则![]() 、
、![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,故C错误;
,故C错误;
D. 当V(NaOH) = 20 mL时,与氢氧化钠溶液恰好反应,溶液中溶质为![]() ,图象分析可知溶液呈碱性,依据质子守恒可知:
,图象分析可知溶液呈碱性,依据质子守恒可知:![]() ,故D错误;
,故D错误;
综上所述,答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO
【题目】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
C(s) | H2O(g) | H2(g) | |||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
下列说法正确的是( )
A.T1<T2B.乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol
C.混合气体的密度始终保持不变D.K2=1.35