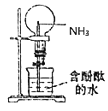
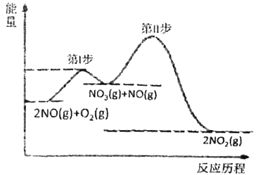
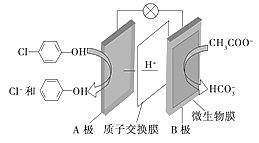
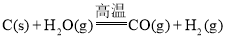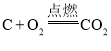题目内容
【题目】在密闭容器中,一定条件下进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
A.加催化剂B.升高温度C.充入CO2D.降低压强
【答案】B
【解析】
A.催化剂只能改变化学反应速率,而不能使化学平衡发生移动,因此不能提高CO2的转化率,A错误;
B.升高温度化学反应速率加快,由于该反应的正反应是吸热反应,升高温度,化学平衡正向移动,CO2的转化率增大,B正确;
C.充入CO2,反应速率加快,但CO2转化率减小,C错误;
D.降低压强,反应速率减小,该反应是反应前后气体体积相等的反应,所以改变压强,化学平衡不移动,CO2的转化率不变,D错误;
故合理选项是B。

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO