题目内容
1. 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
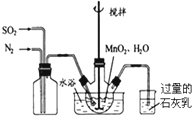
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(1)制备MnSO4溶液:在烧瓶中(装置见如图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤.
①写出左边集气瓶的作用混合SO2和N2.
②石灰乳的作用是:SO2+Ca(OH)2=CaSO3+H2O(用化学方程式表示)
③写出MnO2和H2SO3反应的离子反应方程式MnO2+H2SO3=Mn2++SO42-+H2O.
④反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有ac(选择选项填空).
a.缓慢通入混合气体 b.快速通入混合气体c.控制适当的温度 d.高温加热
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.请补充由(1)制得的MnSO4制备高纯MnCO3的操作步骤【实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】.
①边搅拌边加入Na2CO3,并控制溶液pH<7.7;
②过滤,水洗2~3次;
③检验SO42-是否被洗涤干净.检验水洗是否合格的方法是取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,
若无明显现象,说明水洗合格.
④用少量C2H5OH洗涤,其目的是乙醇容易挥发,便于低温干燥,防止MnCO3受潮被氧化,受热分解;
⑤低于100℃干燥.
分析 (1)①根据实验装置图可知,左边集气瓶的作用是混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,据此书写反应的离子方程式;
④为使SO2尽可能转化完全,一定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①左边集气瓶的作用是混合SO2和N2 ,故答案为:混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应为SO2+Ca(OH)2=CaSO3+H2O,故答案为:SO2+Ca(OH)2=CaSO3+H2O;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,故反应的离子方程式为:MnO2+H2SO3=Mn2++SO42-+H2O,故答案为:MnO2+H2SO3=Mn2++SO42-+H2O;
④使SO2尽可能转化完全,应定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,故选ac;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,所以实验步骤为①边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7,②过滤,用水洗涤2-3次,③检验SO42-是否被洗涤干净,可以取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格,④用少量的乙醇洗涤,主要目的是乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解,
故答案为:过滤,水洗2~3次;取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格;乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程,正确识图、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.

| A. | 同位素的应用已经遍及医学、工业、农业、能源和科学研究的各个领域 | |
| B. | iPhone5外壳易掉色,是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够,导致氧化膜不够致密 | |
| C. | 在日光照射下,NO2与空气中的一些碳氢化合物发生作用后,产生了光化学烟雾 | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe2O3)的原料 |
| A. | 三种气体的分子数目一定相等 | B. | 三种气体物质的量之比为16:2:1 | ||
| C. | 三种气体的密度之比为1:2:16 | D. | 三种气体的压强一定相等 |
| A. | 标准状况下,将足量金属镁在2.24LO2中完全燃烧,转移的电子总数为0.2NA | |
| B. | 1L0.1mol.L-1CH3COOH溶液中所含溶质的分子总数小于0.1NA | |
| C. | 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA | |
| D. | 标准状况下,22.4 L水中含有的氧原子数为1.0NA |
| A. | 纤维素在人体内可水解为葡萄糖,故可做人类的营养物质 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 用硫酸清洗锅炉中的水垢 |