题目内容
11.在2L 2.5mol•L-1溶液中缓慢加入0.1molNa2O2粉末.在一定条件下可实现下图所示操作(由于反应②中加入的氢氧化钠溶液不足.故沉淀C没有完全溶解)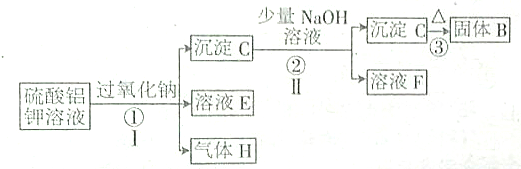
据此回答下列问题:
(1)步骤I、Ⅱ中对于溶液和沉淀的分离采取的方法是过滤
(2)根据上述框图反应关系.写出气体H的化学式:O2
(3)溶液E中含有的离子主要是K+、Na+、Al3+、SO42-
(4)写出②、③两个反应的化学方程式:
②Al(OH)3+NaOH=NaAlO2+2H2O;
③2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
分析 由2Na2O2+2H2O=4NaOH+O2↑,可知0.1molNa2O2可以得到0.2molNaOH、0.05molO2,KAl(SO4)2的物质的量为2L×2.5mol/L=5mol,由Al3++3OH-=Al(OH)3↓,可知OH-不足,故沉淀C为Al(OH)3,溶液E中含有硫酸钾、硫酸铝、硫酸钠,气体H为O2,沉淀C加入少量NaOH,沉淀C没有完全溶解,则F为NaAlO2,沉淀C加热分解生成B为Al2O3,步骤I、Ⅱ是分离互不相溶的固体与液体,应采取过滤操作.
解答 解:由2Na2O2+2H2O=4NaOH+O2↑,可知0.1molNa2O2可以得到0.2molNaOH、0.05molO2,KAl(SO4)2的物质的量为2L×2.5mol/L=5mol,由Al3++3OH-=Al(OH)3↓,可知OH-不足,故沉淀C为Al(OH)3,溶液E中含有硫酸钾、硫酸铝、硫酸钠,气体H为O2,沉淀C加入少量NaOH,沉淀C没有完全溶解,则F为NaAlO2,沉淀C加热分解生成B为Al2O3.
(1)步骤I、Ⅱ是分离互不相溶的固体与液体,应采取过滤操作,故答案为:过滤.
(2)根据上述框图反应关系,可知气体H的化学式:O2,故答案为:O2;
(3)溶液E中含有硫酸钾、硫酸铝、硫酸钠,溶液E中含有的离子主要是:K+、Na+、Al3+、SO42-,故答案为:K+、Na+、Al3+、SO42-;
(4)反应②的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O;
反应③的化学方程式为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查无机物推断,需要学生熟练掌握元素化合物性质,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | Na | B. | Na2O2 | C. | Na2O | D. | Na2CO3 |
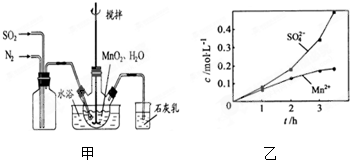
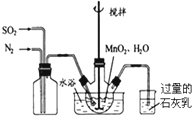 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
 .
.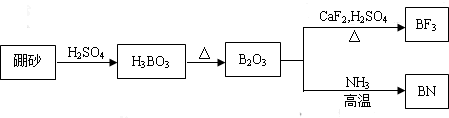
 氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下:
氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下: