题目内容
13.化学兴趣小组对牙膏中摩擦剂成分及其含量进行探究.查资料得知:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成.Ⅰ.取适量牙膏样品,加水充分搅拌、过滤.
(1)往滤渣中加入过量NaOH溶液,过滤.
氢氧化铝与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.
观察到的现象是通入CO2气体有白色沉淀生成;加入盐酸有气体产生、沉淀溶解.
Ⅱ.利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.
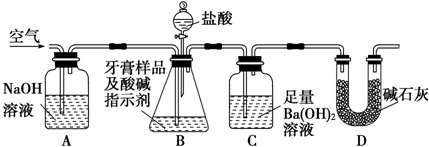
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(4)装置D的作用是防止空气中CO2进入C,影响实验.
(5)下列各项措施中,不能提高测定准确度的是cd(填标号).
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取 8.00g样品三份,进行三次测定,测得BaCO3平均质量为 3.94g.则样品中碳酸钙的质量分数为25%.
Ⅲ.(7)56Ba与Mg在同一主族,Ba在周期表的位置是第六周期IIA族,MgO的碱性比BaO
弱(填“强”或“弱”),Mg(OH)2的溶解度比Ba(OH)2的溶解度小(填“大”或“小”)
分析 Ⅰ.(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠与水;
(2)往(1)所得滤液中先通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,再加入过量稀盐酸,Al(OH)3+3HCl=AlCl3+3H2O,HCO3-+H+=CO2↑+H2O;
Ⅱ.(3)实验通过C装置生成的碳酸钡的质量测定二氧化碳的质量,进而计算牙膏中碳酸钙的质量分数.装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小;
(4)空气中二氧化碳进入C装置后能够与氢氧化钡反应,会影响实验测定,据此可知装置D的作用;
(5)a、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定;
b、滴加盐酸过快CO2,CO2不能完全被吸收,排出装置C;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置,二氧化碳中混有的HCl与碳酸氢钠反应生成二氧化碳,影响了CO2的量;
(6)BaCO3质量为3.94g n(BaCO3)=0.0200mol,则n(CaCO3)=0.0200mol,质量为2.00g;
Ⅲ、(7)依据元素周期表分析Ba元素是56号元素与镁同主族,结合原子核外电子排布规律得到周期表中的位置,依据同主族递变规律分析判断氧化物稳定性和碱的强弱;
解答 解:Ⅰ.(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(2)往(1)所得滤液中先通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,再加入过量稀盐酸,Al(OH)3+3HCl=AlCl3+3H2O,HCO3-+H+=CO2↑+H2O,
故答案为:通入CO2气体有白色沉淀生成;加入盐酸有气体产生、沉淀溶解;
Ⅱ.(3)装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小,持续缓缓通入空气的作用为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
故答案为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收;
(4)由于空气中二氧化碳进入C装置后能够与氢氧化钡反应,影响了实验测定,而装置D可防止空气中CO2进入C,从而避免了对该实验测定的影响,
故答案为:防止空气中CO2进入C,影响实验;
(5)a、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故a错误;
b、滴加盐酸过快CO2,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故b错误;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故c正确;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置,CO2中混有的HCl与碳酸氢钠反应生成二氧化碳,影响了CO2的总量,不能提高测定准确度,故d正确;
故答案为:cd;
(6)BaCO3质量为3.94g,则n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2g,所以样品中碳酸钙的质量分数为:$\frac{2g}{8g}$×100%=25%,
故答案为:25%;
(7)56Ba与Mg在同一主族,Ba为56号元素有六个电子层,最外层电子数为2,在周期表的位置是第六周期IIA族,同主族金属性依次增加,形成碱性增强,MgO的碱性比BaO弱,氢氧化镁难溶于水,氢氧化钡易溶于水,Mg(OH)2的溶解度比Ba(OH)2的溶解度小,
故答案为:第六周期IIA族;弱;小.
点评 本题考查探究物质组成、测量物质含量的方法,题目难度较大,涉及对实验原理与操作步骤的理解及评价、常用化学用语、化学计算、物质组成的测定等知识,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为0.24mol/(L•min).
(2)由表中数据判断△H1<0 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H3=△H2-△H1 (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是b (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡正向移动(填“正向”、“逆向”或“不”),平衡常数KⅡ不变(填“变大”、“变小”或“不变”).
| A. | 一定有元素化合价的升降 | B. | 没有氧参加 | ||
| C. | 氧化反应先于还原反应 | D. | 属于复分解反应 |
| A. | 豆浆 | B. | CuSO4 溶液 | C. | NaCl溶液 | D. | 泥浆水 |
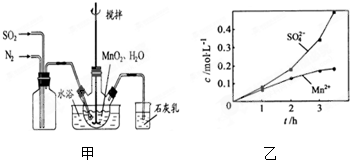
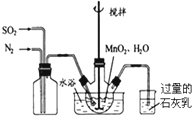 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: 和
和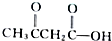 ,试写出A、B的结构简式.
,试写出A、B的结构简式.