题目内容
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,将足量金属镁在2.24LO2中完全燃烧,转移的电子总数为0.2NA | |
| B. | 1L0.1mol.L-1CH3COOH溶液中所含溶质的分子总数小于0.1NA | |
| C. | 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA | |
| D. | 标准状况下,22.4 L水中含有的氧原子数为1.0NA |
分析 A、标况下,2.24L氧气的物质的量为0.1mol,与镁反应后变为-2价;
B、醋酸是弱电解质,在溶液中部分电离;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、标况下,水为液体.
解答 解:A、标况下,2.24L氧气的物质的量为0.1mol,与镁反应后变为-2价,故0.1mol氧气转移0.4mol电子即0.4NA个,故A错误;
B、醋酸是弱电解质,在溶液中部分电离,故溶液中的溶质分子个数小于0.1NA个,故B正确;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于NA个,故C错误;
D、标况下,水为液体,故不能根据气体摩尔体积来计算水的物质的量和含有的氧原子的个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列有关物质的性质或应用正确的是( )
| A. | Na2O用作呼吸面具的供氧剂 | |
| B. | 氧化铝常用于制造耐火材料 | |
| C. | 米汤可检验碘盐中的碘酸钾 | |
| D. | 食品包装袋内放入生石灰可以防止食品因氧化而变质 |
17.某元素M的单质1.8g在过量的O2中充分燃烧,得到M2O33.4g,已知M原子核外电子数比核内中子数少1.该元素在周期表中的位置( )
| A. | 第2周期ⅢA族 | B. | 第2周期ⅥA族 | C. | 第3周期ⅤA族 | D. | 第3周期ⅢA族 |
4.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得
c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为0.24mol/(L•min).
(2)由表中数据判断△H1<0 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H3=△H2-△H1 (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是b (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡正向移动(填“正向”、“逆向”或“不”),平衡常数KⅡ不变(填“变大”、“变小”或“不变”).
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为0.24mol/(L•min).
(2)由表中数据判断△H1<0 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H3=△H2-△H1 (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是b (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡正向移动(填“正向”、“逆向”或“不”),平衡常数KⅡ不变(填“变大”、“变小”或“不变”).
14.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯.用铅笔写一个字消耗石墨的质量约为5×10-4克.那么一个铅笔字含有的碳原子数约为( )
| A. | 2.5×1022个 | B. | 2.5×1019个 | C. | 5×1022个 | D. | 5×1019个 |
18.下列有关氧化还原反应的叙述中,正确的是( )
| A. | 一定有元素化合价的升降 | B. | 没有氧参加 | ||
| C. | 氧化反应先于还原反应 | D. | 属于复分解反应 |
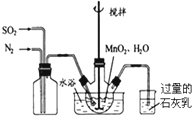 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: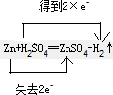 .
.