题目内容
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:
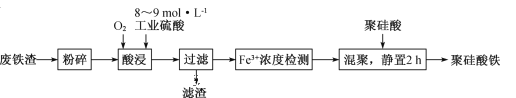
(1)废铁渣进行“粉碎”的目的是______________________。
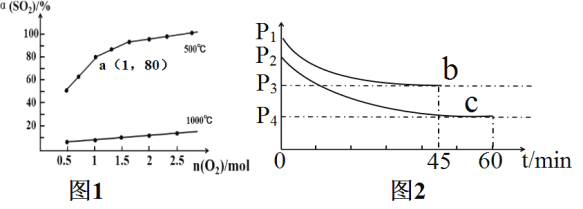
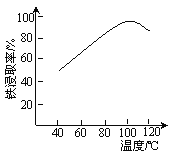
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如图所示。
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_____________。
②酸浸时,通入O2的目的是__________。
③当酸浸温度超过100 ℃时,铁浸取率反而减小,其原因是____________。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为__________。
【答案】增大接触面积,提高反应速率,提高铁元素浸取率 Fe3O4+4H2SO4![]() FeSO4+Fe2(SO4)3+4H2O 将FeSO4氧化为Fe2(SO4)3 温度超过100℃,加快Fe3+水解生成Fe(OH)3,导致Fe3+浓度降低 C和SiO2 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
FeSO4+Fe2(SO4)3+4H2O 将FeSO4氧化为Fe2(SO4)3 温度超过100℃,加快Fe3+水解生成Fe(OH)3,导致Fe3+浓度降低 C和SiO2 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
【解析】
(1)为了使原料充分反应,粉碎废铁渣;
(2)①Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁、水;
②溶液中有亚铁离子,氧气可将亚铁离子氧化为铁离子,可根据电子守恒、电荷守恒及原子守恒写出此反应的离子方程式;
③考虑温度对铁离子水解的影响;
(3)碳和二氧化硅不溶于稀硫酸;
(4)已知:在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,再根据得失电子守恒和原子守恒可得。
(1)对废铁渣进行粉碎的目的是:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;
(2)①加热条件下酸浸时,Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁,方程式为:Fe3O4+4H2SO4![]() FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O;
②酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子,发生反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
③铁离子在水溶液中存在水解,温度升高有利于水解反应的进行,温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低;
(3)废铁渣(主要成分Fe3O4,少量碳及二氧化硅),用酸浸泡,碳与二氧化硅不溶于稀硫酸也不能发生反应,故滤渣的主要成分是C和SiO2;
(4)在酸性条件下,再用K2Cr2O7标准溶液滴定滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,发生的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。