题目内容
【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
【答案】A
【解析】
A.20min内△n(CO)=0.20mol,则△n(H2)=0.40mol,所以20min时容器内氢气的物质的为0.60mol-0.40mol=0.20mol,到30min时氢气的物质的量没有发生变化说明反应达到平衡,该过程中△n(CO)=0.20mol,△n(H2)=0.40mol,根据方程式可知平衡时n(CH3OH)=0.20mol,容器体积为1L,c(CH3OH)=0.20mol/L,温度升高c(CH3OH)减小,说明平衡左移,则正反应为放热反应,即△H<0,选项A正确;
B.容器体积为1L,20min内v(CO)=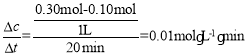 -1,同一时段内反应速率之比等于计量数之比,所以v(H2)=2 v(CO)=0.02mol·L-1·min-1,选项B错误;
-1,同一时段内反应速率之比等于计量数之比,所以v(H2)=2 v(CO)=0.02mol·L-1·min-1,选项B错误;
C.平衡时体系内n(CO)=0.10mol ,n(H2)=0.20mol,n(CH3OH)=0.20mol,若再通入0.10molCO、0.20mol H2、0.20mol CH3OH,同时将容器体积扩大为原来的2倍,则达到等效平衡,而保持其他条件不变,向容器中再通入0.20molCO、0.20mol H2、0.20mol CH3OH,相当于在等效平衡的基础上再加入0.10molCO,同时增大压强,则平衡右移,即v正>v逆,选项C错误;
D.初始投料为0.30molCO和0.60molH2,若完全反应则生成0.30mol CH3OH,即该温度下向容器内加入0.30mol CH3OH可以达到完全一样的平衡状态,平衡时n(CH3OH)=0.20mol,CH3OH的转化率为![]() ,而加入1mol CH3OH相当于等效平衡的基础上加压,反应
,而加入1mol CH3OH相当于等效平衡的基础上加压,反应![]() 的平衡会右移,导致CH3OH的转化率减小,选项D错误;
的平衡会右移,导致CH3OH的转化率减小,选项D错误;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。试写出:
(1)a粒子的原子结构示意图是______________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,实验室制备d气体的化学方程式为________;若d为正四面体形分子,其重要应用之一为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。