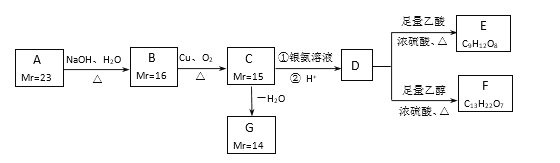
题目内容
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
【答案】B
【解析】
NO、CO2的混合气体通过足量的Na2O2发生反应有2Na2O2+2CO2═2Na2CO3+O2、2NO+O2═2NO2,问题的关键在于NO与氧气反应存在着三种可能性,一种情况是恰好反应,一种情况是NO过量,另一种情况可能是O2过量,据此讨论计算。
NO、CO2的混合气体通过足量的Na2O2发生反应有(1)2Na2O2+2CO2═2Na2CO3+O2、(2)2NO+O2═2NO2,假设参加反应的CO2为x mL,NO为ymL,则x+y=10,由方程式得以下关系:
①2CO2+ 2Na2O2= 2Na2CO3+ O2
2mL 1mL
xmL ![]() mL
mL
②2NO + O2 = 2NO2
2mL 1mL 2mL
ymL ![]() mL
mL
当反应②恰好反应时,即当y=x时(此时x、y都等于5),生成的NO2的体积为5mL,显然符合题意,A正确;当y>x时,NO有过量,O2反应完,此时反应掉的NO为xmL,则剩余的NO为(ymL-xmL),生成的NO2气体为xmL,因此反应最后得到的混合气体为NO和NO2,其体积和为(ymL-xmL)+xmL=ymL,结合x+y=10,再根据NO过量的前提条件为y>x,可以得出结论y>5,这与题意“气体体积缩小为5mL”不符,B错误;当y<x时,NO不足,O2过量,此时反应掉的O2为![]() mL,剩余的O2为(
mL,剩余的O2为(![]() —
—![]() )mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(
)mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(![]() —
—![]() )mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
)mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。

 优加精卷系列答案
优加精卷系列答案【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
【答案】(1)H2SO3 (2)①2SO2+O2![]() 2SO3
2SO3
②使SO3凝结成固体与SO2分离 5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+
③3SO2+4NaOH=Na2SO3+2NaHSO3+H2O
【解析】
(1)观察第三组可知,第二组中X物质应该属于硫呈+4价的含氧酸,即亚硫酸
(2)①SO2在V2O5的催化作用下可被氧化为SO3
②由所给数据可知SO3在冰水中呈固态,所以II装置是通过冷凝将混合气体分离
SO2可将酸性KMnO4中的锰元素还原,且有酸生成(溶液pH降低),故反应方程式为:5SO2+ 2H2O + 2MnO4-="=" 5SO42-+ 2Mn2++ 4H+
③SO2与NaOH溶液反应与两者的物质的量比有关:
SO2+ 2NaOH = Na2SO3+ H2O SO2+ NaOH =NaHSO3
现两者的物质的量比为4:7,直接由总方程式根据元素守恒来配平即可
【题型】实验题
【结束】
29
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3 - |
B | 用洁净的铂丝蘸取某溶液在火焰上灼烧,观察到火焰显黄色 | 该溶液中一定存在Na+,一 定没有K+ |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和 0.1mol/L CH3COONa 溶液的pH | 比较HC1O 和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A. A B. B C. C D. D