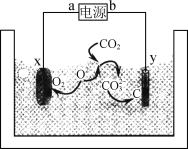
题目内容
【题目】![]() 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用![]() 混合溶液与
混合溶液与![]() 溶液反应制取
溶液反应制取![]() ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题:
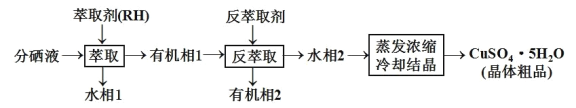
(1)图甲中仪器B的名称是__________,制备过程中![]() 过量会发生副反应生成
过量会发生副反应生成![]() ,为提高产率,仪器A中所加试剂应为__________________;
,为提高产率,仪器A中所加试剂应为__________________;
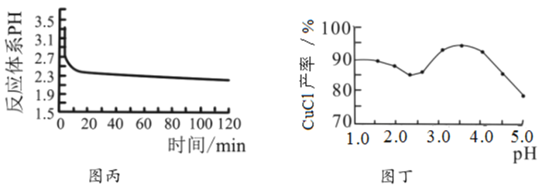
(2)丙图是体系pH随时间变化关系图,制取![]() 反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用![]() 混合溶液代替单一
混合溶液代替单一![]() 溶液,其中
溶液,其中![]() 的作用是____________;
的作用是____________;
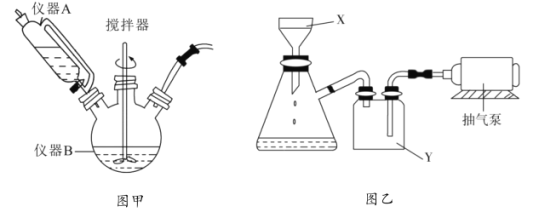
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的____________________,跟常规过滤相比,采用抽滤的优点是____________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________。
(4)![]() 不稳定易分解为
不稳定易分解为![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 的
的![]() ,把
,把![]() 固体和
固体和![]() 溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
【答案】三颈烧瓶 ![]() 溶液
溶液 ![]() 利用
利用![]() 的碱性及时除去系统中反应生成的
的碱性及时除去系统中反应生成的![]() 压强减小 可加快过滤速度、得到较干燥的沉淀 洗去晶体表面的杂质离子,同时防止
压强减小 可加快过滤速度、得到较干燥的沉淀 洗去晶体表面的杂质离子,同时防止![]() 被氧化
被氧化 ![]()
【解析】
在图甲的装置的三颈烧瓶中CuSO4—NaCl混合溶液中加入Na2SO3溶液,反应生成CuCl沉淀,反应过程中溶液中H+的浓度增大,根据丁图是CuCl的产率随pH变化关系图可知,pH在3.5左右,CuCl的产率比较高,为了得到更多的CuCl,实验过程中用Na2SO3—Na2CO3溶液代替Na2SO3溶液来调控溶液的pH,CuCl在潮湿空气中很容易被氧化,所以用去氧水而不用普通的纯净水洗涤CuCl产品,主要是防止CuCl被氧化。
(1)图甲中仪器B为三颈烧瓶;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,可控制Na2SO3的加入量,仪器A中所加试剂应为Na2SO3溶液;
(2)CuSO4—NaCl混合溶液中加入Na2SO3溶液,反应生成CuCl沉淀,同时溶液的酸性增强,生成硫酸,反应的离子方程式为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;结合图丁可知,pH在3.5左右,CuCl的产率比较高,故用Na2SO3—Na2CO3溶液代替Na2SO3溶液,可与生成的H+反应,及时除去系统中反应生成的H+,有利于CuCl的生成;
(3)抽滤又称减压过滤,真空过滤,利用抽气泵使抽滤瓶中的压强降低,达到固液分离的目的方法,故抽气泵的作用是使吸滤瓶与安全瓶中的压强减小;跟常规过滤相比,采用抽滤的优点是:①过滤速度快、②得到的固体比较干燥;CuCl在潮湿空气中可被迅速氧化,所以用“去氧水”作洗涤剂洗涤产品,作用是洗去晶体表面的杂质离子,同时防止CuCl被氧化;
(4)由题意可知,氢氧化亚铜的溶度积小于氯化亚铜的溶度积,对应化学式中阴阳离子个数比相同的物质,溶度积越大,该物质的溶解度就越大,溶度积大的物质会向溶度积小的物质转化,所以把氯化亚铜和氢氧化钠溶液混合,二者反应生成氢氧化亚铜,反应方程式为CuCl(s)+OH-(aq)![]() Cl-(aq)+CuOH(s),CuOH受热分解生成砖红色的Cu2O,2CuOH
Cl-(aq)+CuOH(s),CuOH受热分解生成砖红色的Cu2O,2CuOH![]() Cu2O+H2O。
Cu2O+H2O。

【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()