题目内容
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。试写出:
(1)a粒子的原子结构示意图是______________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,实验室制备d气体的化学方程式为________;若d为正四面体形分子,其重要应用之一为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。
【答案】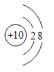 NaOH>Mg(OH)2 NH3+H2O
NaOH>Mg(OH)2 NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- 2NH4Cl+Ca(OH)2
NH4++OH- 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 作为燃料 OH- H3O+ OH-+H3O+=2H2O
CaCl2+2NH3↑+2H2O 作为燃料 OH- H3O+ OH-+H3O+=2H2O
【解析】
a、d和g不带电荷,说明是分子或者原子, e带2个单位正电荷,说明e为 Mg2+,b和f带1个单位的正电荷,可能是Na+、H3O+、NH4+,b的离子半径大于e的离子半径,因此b为Na+,c带一个单位负电荷,可能是F-、OH-、NH2-,又c与f可形成两个共价型g分子,那么c为OH-,f为H3O+,g为H2O,据此分析作答。
(1)a为原子,即为Ne,原子结构示意图为: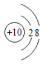 ;
;
(2)b为Na+,e为 Mg2+,相应元素的最高价氧化物对应水化物的碱性强弱比较为NaOH>Mg(OH)2;
(3)若d极易溶于水,说明d为NH3,NH3溶于水形成NH3H2O,电离后生成NH4+和OH-,在水溶液中变化的方程式为NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-;
NH4++OH-;
(4)c为OH-,f为H3O+,g为H2O,OH-与H3O+生成H2O的离子方程式为:OH-+H3O+=2H2O。

【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
【题目】如何除去杂质、提纯下列各物质?请在表中填空。
混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
(1)FeCl2中含少量FeCl3杂质 | _______ | __________________ |
(2)FeCl3中含少量FeCl2杂质 | _______ | __________________ |
(3)FeSO4中含少量CuSO4杂质 | _______ | __________________ |