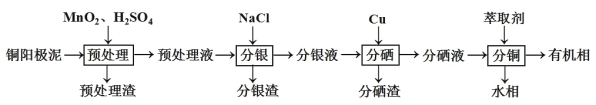
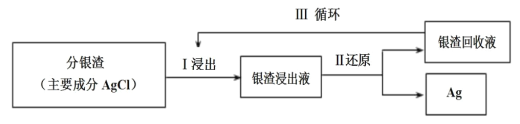
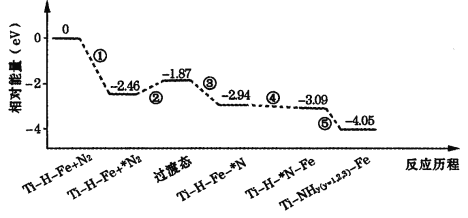
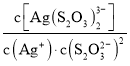题目内容
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+,请你设计实验,简述操作过程,并写出必要的离子方程式_____________________
【答案】取样,向其中滴加KSCN溶液,无明显现象;再向其中滴加氯水,溶液呈血红色,涉及反应的离子方程式有①2Fe2++Cl2→2Fe3+2Cl-、②2Fe3++3SCN-![]() Fe(SCN)3。
Fe(SCN)3。
【解析】
KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先检测不含Fe3+,再证明有有Fe3+。
因为KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,涉及反应的离子方程式有2Fe2++Cl2→2Fe3+2Cl-、2Fe3++3SCN-![]() Fe(SCN)3。
Fe(SCN)3。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
【题目】如何除去杂质、提纯下列各物质?请在表中填空。
混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
(1)FeCl2中含少量FeCl3杂质 | _______ | __________________ |
(2)FeCl3中含少量FeCl2杂质 | _______ | __________________ |
(3)FeSO4中含少量CuSO4杂质 | _______ | __________________ |