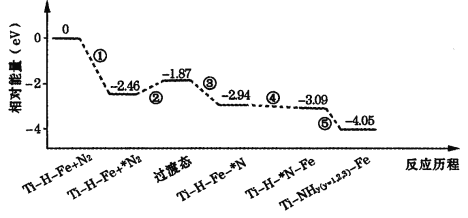
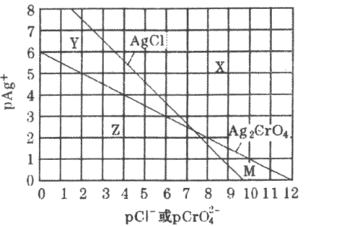
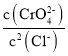题目内容
【题目】下列关于物质性质的叙述正确的是( )
A.SiO2与浓盐酸在高温下能反应生成SiCl4
B.木炭与浓硫酸共热可生成CO2
C.明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D.向饱和食盐水中通入足量CO2可制得NaHCO3
【答案】B
【解析】
A.二氧化硅与浓盐酸不反应,故A错误;
B.木炭与浓硫酸共热发生反应C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,故B正确;
2SO2↑+CO2↑+2H2O,故B正确;
C.明矾溶液中加入过量NaOH溶液可先生成氢氧化铝沉淀,之后氢氧化铝沉淀和NaOH反应生成偏铝酸钠,得不到Al(OH)3胶体,故C错误;
D.二氧化碳在饱和食盐水中的溶解度很小,不能生成碳酸氢钠,可先在饱和食盐水中通氨气,再通足量二氧化碳,故D错误;
故答案为B。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】用下图所示装置分别进行下列实验:将①中溶液滴入②中,按要求填写下列空格:

方案 | ①中物质 | ②中物质 | 填空编号及要求 |
实验1 | 滴加过酚酞的水 | Na2O2 | 写出会看到的现象①_____ |
实验2 | NaOH溶液 | 未打磨过的铝条 | 写出所发生反应的离子方程式 ②_____ |
实验3 | 盐酸 | NaAlO2溶液 | 画出生成沉淀量随盐酸的加入的变化图象 ③_____ |
实验4 | 稀盐酸 | Na2CO3与NaOH的混合溶液 | 已知生成气体量随盐酸的加入的变化图象如下,则原溶液中的Na2CO3与NaOH的物质的量浓度之比为 ④_____
|
实验5 | FeCl3和盐酸的混合液 | 等质量的铜、锌、铁三种金属的混合物 | 若反应后无固体剩余,则反应后的溶液中一定存在的阳离子是 ⑤_____ |
【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
【题目】如何除去杂质、提纯下列各物质?请在表中填空。
混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
(1)FeCl2中含少量FeCl3杂质 | _______ | __________________ |
(2)FeCl3中含少量FeCl2杂质 | _______ | __________________ |
(3)FeSO4中含少量CuSO4杂质 | _______ | __________________ |