题目内容
铜锢稼硒(CIGS )等化合物薄膜太阳能电池是第三代太阳能电池之一。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)砷、硒、溴为第4周期相邻元素,其中电负性最大的是 (填元素符号,下同);第一电离能最小的是 。
(3)硼、铝与镓处于同一主族。
① AlC13在NaCl、KCl融烙盐中能形成A12C17-其结构如图所示。其中A1 原子的杂化轨道类型为 ,配位键数目为 。

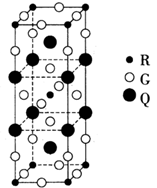
②B元素可形成B70单质,它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为 ,该化合物中的化学键类型有 。

(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)砷、硒、溴为第4周期相邻元素,其中电负性最大的是 (填元素符号,下同);第一电离能最小的是 。
(3)硼、铝与镓处于同一主族。
① AlC13在NaCl、KCl融烙盐中能形成A12C17-其结构如图所示。其中A1 原子的杂化轨道类型为 ,配位键数目为 。

②B元素可形成B70单质,它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为 ,该化合物中的化学键类型有 。

| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
(13分)(1)1s22s22p63s23p63d10(2分)
(2)Br(2分) As(2分)
(3)①sp3(1分) 2(2分) ②1∶3(2分) ③AC(2分)
(2)Br(2分) As(2分)
(3)①sp3(1分) 2(2分) ②1∶3(2分) ③AC(2分)
试题分析:(1)基态Cu原子的电子排布式为1s22s22p63s23p63d104s1,则基态Cu+的电子排布式为1s22s22p63s23p63d10;(2)同周期主族元素从左到右,电负性逐渐增大,则As<Se<Br;第一电离能总体增大,但第IIA、VA族元素比相邻元素大,则Se<Br<As;(3)①铝原子周围形成4个化学键,说明它采取sp3杂化方式;每个铝原子形成3个共价键、1个配位键,则1个A12C17-中含有2个配位键;②由均摊法可知,1个晶胞中所含B70的数目为8×1/8+1=2,K原子数为6×2×1/2=6,则它们之比为2∶6=1∶3;活泼金属与非金属原子之间形成离子键,非金属原子之间形成非极性键,故AC正确。

练习册系列答案
相关题目
 为碳原子,
为碳原子,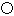 为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。


 2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。