题目内容
氮、磷、锌是与生命活动密不可分的元素。请回答下列问题:
(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是______。
(3)氮化硼(BN)的一种晶体结构与金刚石相似,则B-N-B之间的夹角是____________。氮化砸的密度为3.52g/cm3,则B-N键的键长是______pm (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(4)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是____________;
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为20 mL,则H3PO2的结构式是____________。
(5)Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是________________________
(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是______。
(3)氮化硼(BN)的一种晶体结构与金刚石相似,则B-N-B之间的夹角是____________。氮化砸的密度为3.52g/cm3,则B-N键的键长是______pm (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(4)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是____________;
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为20 mL,则H3PO2的结构式是____________。
(5)Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是________________________
(15分)(1)NH3(1分) N的电负性大于P (1分)(2)sp3杂化(1分)、sp2杂化 (1分)
(3)109°28′(1分) ×1010(2分)
×1010(2分)
(4)①P原子提供孤对电子O原子提供空轨道形成配位键 (2分)
②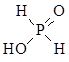 (或
(或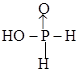 )(2分)
)(2分)
(5)[Ar]3d10(1分);ZnO (1分);同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高 (2分)
(3)109°28′(1分)
 ×1010(2分)
×1010(2分)(4)①P原子提供孤对电子O原子提供空轨道形成配位键 (2分)
②
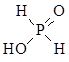 (或
(或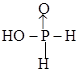 )(2分)
)(2分)(5)[Ar]3d10(1分);ZnO (1分);同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高 (2分)
试题分析:(1)由于N的电负性大于P的,即非金属性N强于P,所以NH3和pH3相比,其中极性较大的是NH3。
(2)NH4NO3是由NH4+和NO3-构成的离子化合物。其中NH4+是正四面体形结构,N元素是sp3杂化。NO3-中N原子含有的孤对电子对数=(5+1-3×2)÷2=0,所以NO3-是平面三角形结构,因此N原子的杂化方式是sp2杂化。
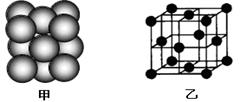
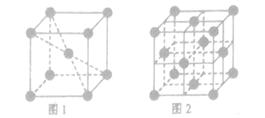
(3)氮化硼(BN)的一种晶体结构与金刚石相似,金刚石是正四面体形结构,因此氮化硼也是正四面体形结构,则B-N-B之间的夹角是109°28′。金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,如图所示
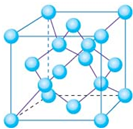 。所以金刚石的一个晶胞中含有的碳原子数=8×
。所以金刚石的一个晶胞中含有的碳原子数=8×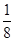 +6×
+6×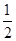 +4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子。设B-N键长为x,立方体的边长是a,则(4x)2=a2+2a2,解得x=
+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子。设B-N键长为x,立方体的边长是a,则(4x)2=a2+2a2,解得x=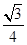 a。又因为
a。又因为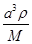 ×NA=4,解得a=
×NA=4,解得a=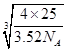 ,所以B-N键长是
,所以B-N键长是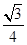
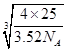 cm=
cm=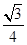
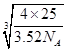 ×1010pm。
×1010pm。(4)①由于磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,所以P与非羟基O之间的共价键的形成方式是P原子提供孤对电子O原子提供空轨道形成配位键。
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为20 ml,这说明次磷酸是一元酸,即含有1个羟基,所以次磷酸的结构式为
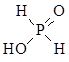 (或
(或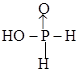 )。
)。(5)锌的原子序数是30,则根据构造原理可知,Zn2+基态时的电子排布式是[Ar]3d10。ZnO和ZnS的晶体结构相似,均是离子晶体。由于O2-半径小于S2-半径,故ZnO晶格能大(或离子键强),熔点高,即其中熔点较高的是ZnO。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目






 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
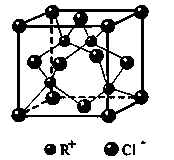
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。