题目内容
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是 。
(3)B分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”) 。
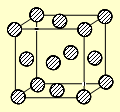
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu的基态原子电子排布式为 。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子。
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是 。
(3)B分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”) 。
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu的基态原子电子排布式为 。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子。

(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 。
(13分)(1)N>O>Cl>S(2分)
(2)HF分子间形成氢键(1分) (3)V形(1分) 极性分子(1分)
(4)Cu+2H++H2O2=Cu2++2H2O(3分) [Ar]3d104s1(1分) 4(1分)
(5)sp3(1分) 2(1分) CO(1分)
(2)HF分子间形成氢键(1分) (3)V形(1分) 极性分子(1分)
(4)Cu+2H++H2O2=Cu2++2H2O(3分) [Ar]3d104s1(1分) 4(1分)
(5)sp3(1分) 2(1分) CO(1分)
试题分析:常见18电子的微粒有:单核分子是Ar;离子是K+、Ca2+、CI-、S2-。双核分子是F2、HCI;离子是HS-。三核的分子是H2S。四核的分子是PH3、H2O2。五核的分子是SiH4。六核的分子是N2H4。根据分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料可知,A是HCl,B是H2S,C是H2O2,D是N2H4。
(1)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的,则A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为N>O>Cl>S。
(2)由于HF分子间形成氢键,所以HF的沸点高于HCl的沸点。
(3)H2S分子中中心原子S原子含有的孤对电子对数=(6-2×1)÷2=2,所以H2S是V形结构,属于极性分子。
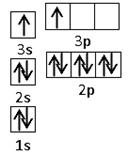
(4)双氧水具有强氧化性,在酸性条件下和铜反应的离子方程式是Cu+2H++H2O2=Cu2++2H2O。根据构造原理可知,铜原子的核外电子排布式是[Ar]3d104s1。根据晶胞的结构并依据均摊法可知,晶胞中含
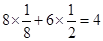 个铜原子。
个铜原子。(5)在根据N2H4分子的结构可知,该化合物相当于是氨气中的1个氢原子被-NH2代替,所以根据氨气的结构式可知,N2H4分子中氮原子是sp3杂化。氮气中含有氮氮三键,所以含有1个α键和2个π键。由于原子数和价电子数分别都相等的是等电子体,则和氮气互为等电子体的是CO。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
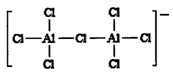
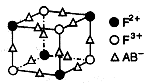
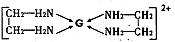 该配离子中含有的化学键类型有 (填字母编号)。
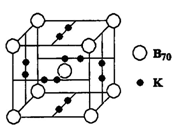
该配离子中含有的化学键类型有 (填字母编号)。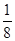 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。