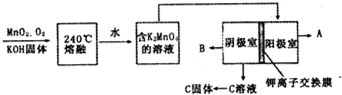
题目内容
2.铁镍蓄电池,放电时的总反应为:Fe+Ni2O3+3H2O $?_{充电}^{放电}$ Fe(OH)2+2Ni(OH)2下列有关该电池的说法正确的是( )| A. | 电池的电解液为碱性溶液,负极为Ni2O3、正极为Fe | |
| B. | 电池放电时,阴极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
分析 铁镍蓄电池放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,最终生成Ni(OH)2,所以正极反应为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,
则充电时,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,阴极附近溶液的pH升高.
解答 解:A、由放电时的反应可以得出:铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故A错误;
B、电池放电时,负极反应为Fe+20H-一2e-═Fe(OH)2 ,不是阴极,故B错误;
C、充电时阳极失电子发生氧化反应,电极反应式为:2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,所以阳极附近溶液的pH降低,阴极附近pH升高,故C错误;
D、充电时阳极失电子发生氧化反应,电极反应式为:2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,故D正确;
故选D.
点评 本题考查二次电池的工作原理,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应,题目难度中等.

练习册系列答案
相关题目
12.能量之间是可以相互转化的.下列过程中,有电能转化为化学能的是( )
| A. | 电解水 | B. | 光合作用 | C. | 打手机 | D. | 点燃氢气 |
13.下列有关离子方程式推理正确的是( )
| 已知 | 类推 | |
| A | 将铁加到硫酸铜溶液中 Fe+Cu2+=Fe2++Cu | 将钾加到硫酸铜溶液中 2K+Cu2+=2K++Cu |
| B | 向Ca(ClO)2溶液中通入CO2气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入SO2气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 将少量碳酸钙粉末投入到足量的盐酸中 CaCO3+2H+=Ca2++CO2↑+H2O | 将少量碳酸钙粉末投入到足量的硝酸溶液中 CaCO3+2H+=Ca2++CO2↑+H2O |
| D | SO2气体通入BaCl2溶液中,不反应,因为H2SO3的酸性弱于盐酸 | SO2气体通入Ba(NO3)2溶液中也不反应,因为H2SO3的酸性弱于硝酸 |
| A. | A | B. | B | C. | C | D. | D |
10.往100mL氢离子浓度为1mol•L-1的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况).则反应前的混合液中含硫酸的物质的量为( )
| A. | 0.01mol | B. | 0.02 mol | C. | 0.03 mol | D. | 0.04 mol |
7.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 蛋白质只含C、H、O、N四种元素 | |
| D. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 |
14.下列反应的离子方程式中,不正确的是( )
| A. | 用碳棒作电极电解硫酸铜溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O$\stackrel{通电}{→}$C6H5OH+HCO${\;}_{3}^{-}$ |
11.下列各组离子在给定条件下一定能大量共存的是( )
| A. | 使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 含有大量NO${\;}_{3}^{-}$的溶液中:NH${\;}_{4}^{+}$、I-、SO42-、H+ | |
| C. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO${\;}_{3}^{-}$、Mg2+ | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、[AI(OH)4]、K+ |
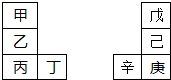 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,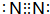 ,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.
,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.